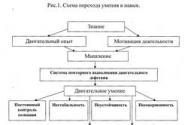
Полипептиды входят в состав чего. Что такое полипептид, строение цепи и пептидной связи. Связывание аминокислот между собой
Полипептиды это белки, которые обладают повышенной конденсационной степенью. Они имеют широкое распространение среди организмов как растительного, так и животного происхождения. То есть здесь речь идет о компонентах, которые являются обязательными. Они отличаются чрезвычайным разнообразием, причем нет грани четкого характера между такими веществами и обычными белками. Если говорить о разнообразии таких веществ, то надо отметить что когда они формируются, в этом процессе участвуют не менее 20 аминокислот протеногенного типа, а если говорить о количестве изомеров, то их можно быть до бесконечности.
Именно поэтому молекулы белкового типа имеют столько возможностей, которые практически безграничны, когда речь идет об их полифункциональности. Так что, понятно почему белки называют основной всего живого, что есть на Земле. Белки называют ещё и одними из самых сложных веществ, которые когда либо были сформированы природой, также они очень уникальны. Так же, как и протеин, белки способствуют активному развитию живых организмов.
Если говорить максимально конкретно, то речь идет о веществах, которые представляют собой биополимеры, в основе которых лежат аминокислоты, содержащие не менее сотни остатков аминокислотного типа. Причем, здесь также есть деление – есть такие вещества, которые относятся к низкомолекулярной группе, они включает в себя всего несколько десятков остатков аминокислот, есть также вещества, которые относятся к высокомолекулярным группам, в них таких остатков существенно больше. Полипептид же это такое вещество, которое отличается действительно большим разнообразием в своей структуре и организации.
Группы полипептидов
Все эти вещества в условном порядке делятся на две группы, при таком делении принимаются во внимание особенности их структуры, которые оказывают непосредственное влияние на их функциональность:
- К первой группе можно отнести вещества, которые отличаются типичной белковой структурой, то есть сюда входит цепочка линейного типа и непосредственно аминокислоты. Они встречаются во всех живых организмах, причем, самый большой интерес здесь имеют вещества с повышенной активностью гормонального типа.
- Что касается второй группы, то здесь находятся те соединения, структура которых имеет не самые типичные для белков особенности.
Что представляет собой полипептидная цепь
Полипептидная цепь представляет белковую структуру в состав которой входят аминокислоты, все это имеет прочную связь соединениями пептидного типа. Если говорить о первичной структуре, то речь идет о простейшем уровне структуры молекулы белкового типа. Такая организационная форма отличается повышенной стабильностью.
Когда в клетках начинают образовываться пептидные связи, то первым делом активацию начинает группа карбоксильного типа одной аминокислоты, а уже потом начинает активное соединение с другой подобной группой. То есть полипептидные цепи характеризуются постоянно чередующимися фрагментами таких связей. Здесь есть целый ряд определенных факторов, оказывающих существенное влияние на форму структуры первичного типа, однако этим их влияние не ограничивается. Существует активное влияние на те организации такой цепи, которые имеют высший уровень.
Если говорить об особенностях такой организацинной формы, то они заключаются в следующем:
- происходит регулярное чередование структур, относящимся к жесткому типу;
- есть участки, которые обладают относительной подвижностью, они имеют возможность вращаться вокруг связей. Именно особенности такого рода оказывают влияние на то, каким образом полипептидная цепь укладывается в пространстве. Причем с пептидными цепями могут осуществляться разного рода организационные моменты под воздействием множества факторов. Может быть отсоединение одной из структур, когда пептиды формируются в отдельную группу и отделяются от одной цепи.

Белковая структура вторичного типа
Здесь речь идет о варианте цепной укладки таким образом, чтобы была организована упорядоченная структура, такое становится возможным, благодаря водородным связям между группами пептидов одной цепи с такими же группами другой цепи. Если брать во внимание конфигурацию такой структуры, то она может быть:
- Спирального типа, такое название произошло, благодаря своеобразной форме.
- Слоисто-складчатого типа.
Если говорить о спиральной группе, то это такая белковая структура, которая сформирована в форме спирали, которая образуется, не выходя за пределы одной цепи полипептидного типа. Если говорить о внешнем виде, то она во многом схожа с обычной электрической спиралью, которая есть в плитке, работающей на электричестве.
Что касается слоисто-складчатой структуры, то здесь цепь отличается изогнутой конфигурацией, её формирование осуществляется на основе связей водородного типа, причем, здесь все ограничивается пределами одного участка конкретной цепи.
Что такое полипептид
Полипептид - химическое вещество, состоящее из длинной цепи аминокислот, связанных пептидными связями. Полипептидами являются белки.
Изобразите полиптид с использованием десяти разных аминокислот
Фен - Сер - Охра - Лей - Тре - Асн - Ала - Глу - Арг - Вал
Почему генетический код носит вырожденный характер
Генетический код - вырожден, т.е. большинство аминокислот кодируется более чем одним кодоном. Например, фенилаланин (Phe) кодируется двумя кодонами -UUU и UUC. Кодоны, которые определяют одну и ту же аминокислоту, называются кодонами-синонимами. Вырожденность кода, как правило, выражается в том, что у кодонов, определяющих одну и ту же аминокислоту, первые два основания фиксированы, а третье положение может занимать одно из двух, трех или четырех разных оснований. В частности, кодоны с одним из двух пиримидинов (C или U) в третьем положении всегда являются синонимами, в то время, как кодоны с одним из двух пуринов (A или G) в третьем положении бывают синонимами лишь иногда. Различия по всем трем положениям наблюдаются лишь в некоторых случаях (например, UCG и AGU оба кодируют Ser).
Полипептиды, белки
Биологическая роль белков и полипептидов
Полипептиды и белки – основные вещества живого организма. "Жизнь – это форма существования белковых тел" (Ф.Энгельс). Роль их в обмене веществ уникальна, они выполняют все основные функции метаболизма:
1) Белки – пластический материал тканей;
2) Белки – один из трех видов питательных веществ, необходимых организму;
3) Белковые структуры являются ключевыми в составе ферментов – биохимических катализаторов, "двигателей" метаболизма;
4) Гормоны и вещества, регулирующие пути биохимических превращений – это в основном, полипептиды и белки. Тканевые рецепторы гормонов, биорегуляторов и лекарственных веществ также представляют собой белковые структуры.
Первичная структура полипептидов и белков
Полипептиды и белки – это полимеры, состоящие из остатков аминокислот, связанных между собой пептидными связями.
Условно считается, что полипептиды – это полимеры, содержащие до 100 аминокислотных остатков, более 100 остатков – это белки. Особо выделяются олигопептиды – до 10 аминокислотных остатков.
Полипептиды и белки образуются в результате поликонденсации α-аминокислот:

Физико-химические свойства полипептидов и белков
Молекулы полипептидов и белков имеют в своем составе ионогенные карбоксильные и аминогруппы и, подобно аминокислотам, всегда несут на себе электрический заряд, знак и величина которого зависит от рН раствора.
Все полипептиды и белки характеризуются определенной изоэлектрической точкой (pI ) - значением рН, при котором суммарный заряд молекулы равен нулю.
Если рН раствора ниже изоэлектрической точки (pH < pI), то молекула в целом имеет положительный заряд.
Если рН раствора выше изоэлектрической точки (pH > pI), то молекула в целом имеет отрицательный заряд.
Если количества карбоксильных и аминогрупп в молекуле одинаковы, то изолектрическая точка вещества находится в области нейтрального рН (pI = 7). Это нейтральные полипептиды.
Если в молекуле преобладают карбоксильные группы, то изолектрическая
точка находится в кислотной области рН (pI < 7). Это кислые полипептиды.
Если в молекуле преобладают аминогруппы, то изолектрическая точка находится в основной области рН (pI > 7). Это основные полипептиды.
Растворимость полипептидов в воде зависит от их молекулярной массы.
Олигопептиды и низкомолекулярные полипептиды подобно аминокислотам хорошо растворимы в воде.
Высокомолекулярные белки образуют коллоидные растворы. Их растворимость зависит от рН (т.е. от заряда молекулы). В изоэлектрической точке растворимость белка минимальна и он выпадает в осадок. При подкислении или подщелачивании молекулы снова приобретают заряд и осадок растворяется.
Пространственное строение белков и полипептидов
Высокомолекулярные полипептиды и белки кроме первичной структуры обладают более высокими уровнями пространственной организации – вторичную, третичную и четвертичную структуры.
ПЕПТИДНАЯ ГРУППА

Вторичная структура
1) α-спираль
Строение пептидной группировки определяет пространственное строение полипептидной цепи.
Л.Полинг (1950 г.) расчетным путем показал, что для α-полипептиной цепи одной из наиболее вероятных является структура правозакрученной α-пирали. Вскоре это было экспериментально подтверждено рентгено-структурным анализом:

Между С=О 1-го и N-H 5-го аминокислотных остатков образуются водородные связи, направленные почти параллельно оси спирали, они скрепляют спираль. Боковые радикалы R расположены по периферии спирали.
2) β-складчатая структура
В этом виде вторичной структуры вытянутые одна вдоль другой полипептидные цепи образуют водородные связи между собой:



Многие белки имеют вторичную структуру с чередующимися фрагментами α-спирали и β-складчатой структуры.
Третичная структура
α-Спираль, будучи достаточно протяженной, изгибаясь, складывается в клубок. Это происходит в результате взаимодействия боковых радикалов достаточно удаленных друг от друга. Образуется глобула:

Виды взаимодействия, формирующие третичную структуру
1) Водородные связи

2) Ионное взаимодействие

3) Гидрофобное взаимодействие

4) Дисульфидные связи

Четвертичная структура
Четвертичная структура – это агрегат субъединиц – глобул. Она формируется теми же видами взаимодействия, что и третичная структура:


Четвертичная структура белка Четвертичная структура гемоглобина
Четвертичной структурой обладают некоторые сложные белки – гемоглобин, некоторые ферменты и др.
ЛИТЕРАТУРА :
Основная
1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 207-227.
2. Тюкавкина Н.А., Бауков Ю.И.– Биоорганическая химия – ДРОФА, М., 2007 г., с. 314-315, 345-369.
Согласно пептидной теории основой структуры белковой молекулы признана полипептидная цепь. Эта цепь построена из нескольких десятков, а иногда и сотен остатков аминокислот, связанных между собой пептидными связями.
Доказательства. Синтез полипептидов.
Белки – высокомолекулярные азотосодержащие вещества, находящиеся в клетках, преимущественно в коллоидном состоянии, то есть в состоянии, характеризующиеся крайней неустойчивостью, состав которых зависит от свойств среды.
Mrбелков зависит от количества аминокислот в молекуле.
Белки – мономолекулярные соединения.
Цитохром С – 104 аминокислотных остатка, Mrпостоянна.
Связывание аминокислот между собой
Первое
предположение о строении белков 1888 г
Данилевским с щелочными растворами
CuSO 4 все белки дают
сине-фиолетовое окрашивание. Аналогичную
реакцию дают пептоны – продукт расщепления
белков протолитическими ферментами,
подобное дает биурет:,
диамид малоновой кислоты:![]() Есть
подобные связи:C=O;N-H
Есть
подобные связи:C=O;N-H
В белках амидная связь, которая образуется за счет взаимодействия карбоксильной по 1-ой аминокислоты и аминогруппы другой аминокислоты

а сами белки – полипептиды
Все усилия сводятся: защита аминогруппы и активация карбоксильной группы, чтобы реагировало то, что нужно:
Это синтез полипептида по Фишеру
2. Метод Бергмана, Зиверса, Курциуса.
Защита по Зервесу: для защиты аминогрупп используются бензиловый эфир Cl – угольной кислоты.

Активация по Курциусу:


надо снять защиту с 1-ой аминокислоты.
Граница между полипептидами и белками проведена условно. К белкам относят полипептиды с молекулярной массой 6 тысяч и более и числом аминокислотных остатков свыше 50. Такой принцип деления основан на способности к диализу через природные мембраны.
Белковая молекула может состоять из одной или нескольких полипептидных цепей. Цепи могут быть соединены между собой ковалентными или не ковалентными связями. Белки, состоящие из двух или нескольких полипептидных цепей, не связанных между собой ковалентными связями, называют олигомерным и. Отдельные полипептидные цепи в таких белках называют протомерами; функционально активные части белка - субъединицами.
2Гемоглобин
ГЕМОГЛОБИН
- осн. белок дыхат. цикла, участвующий в
переносе О2 от органов дыхания к тканям,
а в обратном направлении - СО2. Содержится
в эритроцитах. В организме человека 5-6
л крови, где ½ ~1/3 эритроциты, во взвешенном
состоянии в плазме крови, которая
ежедневно переносит
Образуется из ретикулоцитов.
Гемоглобин – сложный белок. Белковая часть – глобин, небелковая часть – гемм.
Глобин состоит из 4-х попарно одинаковых полипептидных цепей (α-2, β-2). Одна цепь из 146β аминокислотных остатков, другая из 141α.
Гемм – ароматическая плоская структура, содержащаяFe, который связан 6 координационными связями с одной стороны с глобином, с другой с атомами азота пирральных колец гемма, 1-с атомом азота гистидина, 1 – с молекулой кислорода.
Оксигемоглобин = гемоглобин + О2. Координационная связь с кислородом, валентность железа не меняется (II). Неустойчив. Эта связь образуется в результате повышения парциального давления кислорода в легких. При этом меняется трепичная структура глобина. Он становится удобным для удержания
Гемоглобин
– переносчик протонов и углекислого
газа. На связываниеO2 с
гемоглобином влияет рН среды и концентрацияCO 2 . Присоединение
СО 2 и Н + кHbснижает его способность связыватьO2.
В периферических тканях с понижением
рН и повышением концентрации СО 2 ,
сродствоHbк О 2 падает по мере связывания СО 2 и
протонов. В легочных капиллярах выделяется
СО 2 и повышается рН среды в крови,
следовательно повышается сродствоHbк О 2 (эффект Бора).
Протоны присоединяются к радикалам гистидина в 146 положении β-цепи и к другим гистидинам в α-цепи. СО 2 присоединяется к кольцевой α-аминогруппе каждой полипептидной цепи.Hbможет связывать малые молекулыCNиCO. С оксидом углерода (II) связывается легче чем с кислородом и образуется карбоксигемоглобин. При действии некоторых отравляющих окислителей (переводомFe 2+ →Fe 3+) происходит окислениеHbв метгемоглобин. Цвет крови изменяется в коричневый, он не переноситO2, при его повышении наблюдается одышка, легкая утомляемость, резкая головная боль, рвота, потеря сознания, увеличивается печень, серо-синяя окраска слизистых и кожи. Окислители: нитросоед., орг. нитросоед., аминосоед. (анилин, аминофенолы, аминогидрозин и их производные: вакса, краски), хлораты, нафталин, феноны. Окислительно-восстановительные краски: метиленовый, синий.
Лечение. Введение антидотов – восстановителей: глюкоза, сульгидрильные соед. (β – меркаптоэтилаланин, кислородная компрессия (кислородная подушка)).
Это может быть наследственным заболеванием. Происходит если в одной из α цепей глобина в 58 положении вместо гистидина тирозин. Тирозин способствует образованию ковалентной связи вместо координатной и фиксируется степень окисления Fe 3+
У людей ~150 видов мутантных гемоглобинов. Аномалия встречается у 1 из 10000 человек.
Серповидноклеточная анемия. Это наследственное заболевание, под влиянием физических нагрузок возникает одышка, таксикардия, .. в сердце. Содержание Hbв крови уменьшается. Возникают попутные заболевания (почки, сердце, печень). Эритроциты в форме серпов. Они становятся ломкими и быстро выходят из строя, забивают капилляры. Передается детям. Если болеет лишь 1 из родителей, ребенок – носитель (1%), а если гомозиготные, то 50 % эритроцитов. У африканцев 20 % - носители.
Эндемическое заболевания африканцев – малярия, удобные для вируса лишь круглые => основное население вымерло. 8 % негритянского населения – носители гена. В β – цепи в 6 положение вместо глутаминовой кислоты (полярная группа) находится валин (неполярная группа). Валин – липкий участок, к которому присоединяются другие липкие участки → деформирование эритроцитов.