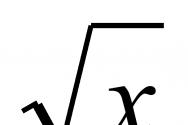Обозначения в таблице менделеева. Железо: происхождение и характеристика. Роль Железа в живом организме
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо - это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar (Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2 e - → Fe +2 , окисляется восстановитель
Fe 0 -3 e - → Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3
2. Распространённость железа
Железо – один из самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию . Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe 3 O 4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
|
|
|
гематит (железный блеск, кровавик)– Fe 2 O 3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
|
|
|
лимонит (бурый железняк) – Fe 2 O 3* nH 2 O содержит до 60% железа, месторождения встречаются в Крыму:

пирит (серный колчедан, железный колчедан, кошачье золото) – FeS 2 содержит примерно 47% железа, месторождения встречаются на Урале.

3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO 2 .
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозиии хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
5. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
FeO + C = Fe + CO
Fe 2 O 3 + 3CO = 2Fe + 3CO 2
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
Опыт "Получение железа алюминотермией"
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
2) Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II,III) - вещество чёрного цвета:
3Fe + 2O 2 = Fe 3 O 4
C кислородом во влажном воздухе образуется Fe 2 O 3 * nH 2 O
Опыт "Взаимодействие железа с кислородом"
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) Железо реагирует с неметаллами при нагревании:
Fe + S t˚C → FeS
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl 2 + H 2
Fe + H 2 SO 4 (разб .) = FeSO 4 + H 2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
2Fe + 6H 2 SO 4 (конц .) t˚C → Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (конц
.) t˚C → Fe(NO 3) 3
+ 3NO 2 + 3H 2 O
Железо (III)
7. Применение железа.
Основная часть получаемого в мире железа используется для получения чугуна и стали - сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок - станин тяжелых машин и т.п.
Изделия из чугуна
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: М
Тренажёр №2 - Генетический ряд Fe 3+
Тренажёр №3 - Уравнения реакций железа с простыми и сложными веществами
Задания для закрепления
№1. Составьте
уравнения реакций получения железа из его оксидов Fe 2 O 3 и
Fe 3 O 4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите
превращения по схеме:
Fe 2 O 3 -> Fe - +H2O,
t -> X - +CO, t -> Y - +HCl ->Z
Назовите продукты X, Y, Z?
МЕТАЛЛЫ ПОБОЧНЫХ ПОДГРУПП
Характеристика переходных элементов – меди, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
Понятие переходный элемент обычно используется для обозначения любого из d- или f-элементов. Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда - в 4-м, 5-м и 6-м периодах соответственно. Первый переходный ряд включает 10 элементов, от скандия до цинка. Он характеризуется внутренней застройкой 3d-орбиталей. Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра). Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы). d-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к обра зованию комплексных ионов; образование окрашенных соединений. d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду. d-Элементы - хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Химические свойства .
Электроотрицательность металлов первого переходного ряда возрастают в направлении от хрома к цинку. Это означает, что металлические свойства элементов первого переходного ряда постепенно ослабевают в указанном направлении. Такое изменение их свойств проявляется и в последовательном возрастании окислительно-восстановительных потенциалов с переходом от отрицательных к положительным значениям.
Характеристика хрома и его соединений
Хром - твердый, голубовато-белый металл.ρ = 7,2г/см 3 , t плавл = 1857 0 С СО: +1,+2,+3,+4,+5,+6Химические свойства.
- При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600 0 C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O 2 2Cr 2 O 3
2Cr + 3Cl 2 2CrCl 3
2Cr + 3S Cr 2 S 3
- В раскалённом состоянии реагирует с парами воды:
2Cr + 3H 2 O Cr 2 O 3 + 3H 2
- Хром растворяется в разбавленных сильных кислотах (HCl, H 2 SO 4). В отсутствии воздуха образуются соли Cr 2+ , а на воздухе – соли Cr 3+ .
Cr + 2HCl → CrCl 2 + H 2 -
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2 -
- Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н 2 SО 4 (конц) Сr 2 (SО 4) 3 + 3 SО 2 + 6 Н 2 О
Сr + 6 НNО 3 (конц) Сr(NО 3) 3 + 3 NO 2 + 3 Н 2 О
Получение.Соединения хрома
Соединения двухвалентного хрома
Оксид хрома (II ) CrO
Физические свойства: твердое нерастворимое в воде вещество ярко-красного или коричнево- красного цвета. Химические свойства. CrO – основной оксид.Получение.
Cr 2 O 3 + 3Н 2 2Cr + 3H 2 O Гидроксид хрома (II ) Сr(ОН) 2 Физические свойства: твердое нерастворимое в воде вещество желтого цвета . Химические свойства. Сr(ОН) 2 – слабое основание.
- Взаимодействует с кислотами: Cr(OH) 2 + 2HCl → CrCl 2 + 2H 2 O Легко окисляется в присутствии влаги кислородом воздуха в Сr(ОН) 3:
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
- При прокаливании разлагается:
- Действием щелочи на растворы солей Cr(II): СrСl 2 + 2 NaОН = Сr(ОН) 2 ↓ + 2 NaСl.
Соединения трёхвалентного хрома
Оксид хрома (III ) Cr 2 O 3 Физические свойства: темно-зеленое тугоплавкое вещество, нерастворимое в воде. Химические свойства. Cr 2 O 3 - амфотерный оксид.Хромит натрия
- При высокой температуре восстанавливается водородом, кальцием, углеродом до хрома:
Cr 2 O 3 + 3Н 2 2Cr + 3H 2 O
Получение.
Гидроксид хрома (III ) Cr (OH ) 3 Физические свойства: нерастворимое в воде вещество зелёного цвета. Химические свойства. Сr(ОН) 3 – амфотерный гидроксид2Cr(OH) 3 + 3H 2 SO 4 →Cr 2 (SO 4) 3 + 6H 2 O
Cr(OH) 3 + KOH → KCrO 2 + 2H 2 O
(хромит калия) Получение.
- При действии щелочей на соли Сr 3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
Сr 2 (SО 4) 3 + 6NaОН → 2 Сr(ОН) 3 ↓ + 3 Na 2 SО 4 ,
Соединения шестивалентного хрома
Оксид хрома (VI ) CrO 3 Физические свойства: твердое вещество темно-красного цвета, хорошо растворимое в воде. Ядовит! Химические свойства. CrO 3 – кислотный оксид.- Взаимодействует со щелочами, образуя соли желтого цвета-хроматы:
CrO 3 + 2KOH → K 2 CrO 4 + H 2 O
- Взаимодействует с водой, образуя кислоты: CrO 3 + H 2 O → H 2 CrO 4 хромовая кислота
- Термически неустойчив: 4 CrO 3 → 2Cr 2 O 3 + 3O 2
- Получают из хромата (или дихромата) калия действием H 2 SO 4 (конц.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
Гидроксиды хрома (VI) H 2 CrO 4 - хромовая кислота , H 2 Cr 2 O 7 - дихромовая кислота Обе кислоты неустойчивы, при попытке их выделения в чистом виде распадаются на воду и оксид хрома (VI). Однако соли их вполне устойчивы. Соли хромовой кислоты называют хроматами, они окрашены в желтый цвет, а соли дихромовой кислоты – дихроматами, они окрашены в оранжевый цвет.Железо и его соединения
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. T плавл =1539 0 С. ρ = 7,87г/см 3 . СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов +3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.Химические свойства.
- Горит в кислороде, образуя окалину - оксид железа (II,III): 3Fe + 2O 2 → Fe 3 O 4 Железо реагирует с неметаллами при нагревании:
- При высокой температуре (700–900C) железо реагирует с парами воды:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 -
- На воздухе в присутствии влаги ржавеет: 4Fе + 3O 2 + 6Н 2 О → 4Fе(ОН) 3 . Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl 2 + H 2 -
Fe + H 2 SO 4 (разб.) → FeSO 4 + H 2 -
- В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H 2 SO 4 (конц.) Fe 2 (SO 4) 3 + 3SO 2 - + 6H 2 O
Fe + 6HNO 3 (конц.) Fe(NO 3) 3 + 3NO 2 - + 3H 2 O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
- Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO 4 → FeSO 4 + Cu↓
Получение.- Восстановлением из оксидов углём или оксидом углерода (II)
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Соединения двухвалентного железа
О ксид железа (II ) FeO
Физические свойства: твердое вещество черного цвета, нерастворимое в воде. Химические свойства: FeО – основной оксид 6 FeО + O 2 2Fe 3 О 4- Восстанавливается водородом, углеродом, оксидом углерода(II) до железа:
Гидроксид железа (II ) Fe (OH ) 2
Физические свойства: порошок белого цвета, нерастворимый в воде. Химические свойства: Fe(OH) 2 – слабое основание. Получение.- Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeCl 2 + 2KOH → 2KCl + Fе(OH) 2 ↓
Качественная реакция на Fe 2+
При действии гексацианоферрата (III) калия K 3 (красной кровяной соли) на растворы солей двухвалентного железа образуется синий осадок (турнбулева синь):3FeSO 4 + 2K 3 Fe 3 2 + 3K 2 SO 4
Соединения трёхвалентного железа
Оксид железа (III ) Fe 2 O 3
Физические свойства: твердое вещество красно-коричневого цвета. Химические свойства: Fe 2 O 3 – амфотерный оксид. феррит натрия Fe 2 О 3 + 3H 2 - 2 Fe + 3H 2 O Получение.Гидроксид железа (III ) Fe (OH ) 3
Физические свойства: твердое вещество красно-бурого цвета. Химические свойства: Fe(OH) 3 – амфотерный гидроксид.- Взаимодействует с кислотами, как нерастворимое основание:
2Fe(OH) 3 + 3H 2 SO 4 →Fe 2 (SO 4) 3 + 6H 2 O
- Взаимодействует со щелочами, как нерастворимая кислота:
Fe(OH) 3 + KOH (тв) → KFeO 2 + 2H 2 O
Fе(ОН) 3 + 3КОН (конц) → К 3
Получение.- Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка:
Fe(NO 3) 3 + 3KOH Fe(OH) 3 + 3KNO 3
Качественные реакции на Fe 3+
- При действии гексацианоферрата (II) калия K 4 (жёлтой кровяной соли) на растворы солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
4FeCl 3 +3K 4 Fe 4 3 + 12KCl
- При добавлении к раствору, содержащему ионы Fe 3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
FeCl 3 + 3KCNS 3КCl + Fe(CNS) 3
Медь и её соединения
Медь - довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло- и электропроводностью. T плавл = 1083 0 С. ρ = 8,96г/см 3 . СО: 0,+1,+2
Химические свойства.
- Взаимодействие с простыми веществами.
- Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO 3 (разб.) → 3Cu(NO 3) 2 + 2NO- + 2H 2 O
Cu + 4HNO 3 (конц.) → Cu(NO 3) 2 + 2NO 2 -+ 2H 2 O
Cu + 2H 2 SO 4 (конц.) → CuSO 4 + SO 2 -+2H 2 O
Получение .
CuO + CO Cu + CO 2
- При электролизе солей меди: 2CuSO 4 + 2H 2 O → 2
Cu
+ O
2
-
+ 2H 2 SO 4
Соединения одновалентной меди
Оксид меди(I ) С u 2 O Физические свойства: твердое вещество красного цвета, нерастворимое в воде. Химические свойства: Сu 2 O – основной оксид. Получение.- Получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
- Взаимодействует с кислотами: CuOH + HCl → CuCl + H 2 O На воздухе легко окисляется до Cu(OH) 2: 4CuOH + О 2 + 2H 2 O → 4 Cu(OH) 2
Соединения двухвалентной меди
Железо (символ Fe) − химический элемент восьмой группы, четвертого периода. Железо в периодической системе химических элементов расположено под номером 26.
В подгруппе Железа содержится 4 элемента: Fe железо, рутений Ru, осмий Os, Hs хасмий.
Характеристика химического элемента Железо
Ferrum - латинское слово, оно означает не только железо, а также твёрдость и оружие. От него произошли названия железа и в некоторых европейских языках: французском fer, итальянском ferro, испанском hierro и такие термины, как ферриты, ферромагнетизм. Похожие названия этого металла в славянских и балтийских языка: литовском gelezis, польском zelazo, болгарском желязо, украинском залiзо и белорусском жалеза. Английское название Iron, немецкое Eisen, голландское ijzer имеют происхождение от санскритского isira (крепкий, сильный).
Распространение Железа в природе
Железо 26 элемент таблицы Менделеева
Железо - первый на земном шаре и второй по распространённости металл в земной коре, очень важный металл для человека. Ещё с незапамятных времён люди встречали железо в виде железных метеоритов. Обычно в метеоритном железе содержится от 5 до 30 % никеля, почти 0,5 % кобальта и до 1 % других элементов. На территории Африки 80 тысяч лет назад упал самый крупный метеорит Гоба, он весил 66 тонн. Он содержит 84 % железа и 16 % никеля. В метеоритном музее Российской академии наук, хранятся два осколка железного метеорита, которые весят 256 кг, упавшего на Дальнем Востоке. В 1947 г. в Приморском крае на площади 35 км 2 «железным дождём» выпали тысячи осколков (массой от 60 до 100 тонн) железного метеорита. Очень редкий минерал - самородное железо земного происхождения, встречается в виде мелких зёрен и содержит 2% никеля и десятые доли процента других металлов. На Луне было найдено самородное железо в раздробленном состоянии.
В 13- 12 веках до н.э. происходит распад и смена культур на всём пространстве Евразии от Атлантики до Тихого океана, и в течение нескольких веков - до 10-8 веков до н.э. происходят переселения народов. Этот период получил название катастрофы бронзового века и начало перехода к железному веку.
Железа в земной коре очень много, но добывать его тяжело. Этот металл прочно связан в рудах с кислородом, а иногда с серой. Древние печи не могли дать нужной температуры, при которой плавится чистое железо и получалось железо в виде губки с примесями из руды, называемой крицей. При ковке крицы, железо частично отделялось от руды.
Во многих минералах содержится железо. Магнитный железняк, содержащий 72,3% железа - самый богатый железом минерал. Древнегреческий философ Фалес Милетский более 2500 лет назад изучил образцы чёрного металла, которые притягивают железо. Дал ему название magnetis lithos - камень из Магнесии, так произошло название магнита. Теперь известно, что это был магнитный железняк - чёрный оксид железа.
Роль Железа в живом организме
Важнейшей рудой железа является гематит. Он содержит 69,9% железа. Гематит ещё называют красный железняк, а старинное название - кровавик. От греческого haima, что означает кровь. Появились и другие слова, связанные с кровью, такие как гемоглобин. Гемоглобин служит переносчиком кислорода от органов дыхания к тканям организма, а в обратном направлении переносит диоксид углерода. Недостаток железа в организме приводит к тяжёлому заболеванию - железодефицитной анемии . При этом заболевании происходят нарушения скелета, функции центральной нервной и сосудистой систем , наблюдается недостаток кислорода в тканях. Железо необходимо живым организмам. Оно содержится также в мышцах, селезёнке и печени. У взрослого человека железа около 4 г, оно присутствует в каждой клетке организма. Человек каждый день с пищей должен получать 15 миллиграммов железа. При недостатке железа врачи назначают специальные препараты, в которых железо находится в легко усвояемом виде.
Применение Железа
Если в выплавляемом железе больше 2% углерода, то получается чугун, его плавят на сотни градусов ниже, чем чистое железо. Так как чугун хрупкий, из него можно только отливать различные изделия, ковать его нельзя. Из железной руды в доменных печах выплавляют большое количество чугуна, который используют для отливки памятников, решёток и тяжёлых станин для станков. Основную массу чугуна перерабатывают в сталь. Для этого в конвертерах или в мартеновских печах из чугуна «выжигают» часть углерода и других примесей.
Из стали с разным содержанием углерода сделаны все предметы от рельсов до гвоздей. Если в железе мало углерода, получается мягкая низкоуглеродистая сталь, а вводя в сталь легирующие примеси других элементов, получаются разные сорта специальных сталей. Известно огромное множество сталей и каждая имеет своё применение.
Самая известная - нержавеющая сталь, которая содержит никель и хром. Из этой стали делают аппаратуру для химических заводов и столовую посуду. А если в сталь ввести 18% вольфрама, 1% ванадия и 4% хрома, получится быстрорежущая сталь, из неё делают свёрла и наконечники резцов. Если сплавить железо с 1,5% углерода и 15% марганца, получается такая твёрдая сталь, из которой делают ножи бульдозеров и зубья экскаваторов. Сталь содержащая 36% никеля, 0,5 % углерода и 0,5% марганца называется инваром, из неё делают точные приборы и некоторые детали для часов. Сталь, которую называют платинитом, содержит 46% никеля и 15% углерода расширяется при нагревании так же как и стекло. Спай платинита со стеклом не растрескивается и поэтому его используют при изготовлении электрических ламп.
Нержавеющая сталь не намагничивается и к магниту не притягивается. Намагнитить можно только углеродистую сталь. Чистое железо само не намагничивается, а притягивается магнитом, такое железо подходит для изготовления сердечников электромагнитов.
В мире ежегодно выплавляется более миллиарда тонн железа. Но коррозия, которая является страшным врагом металла, не только уничтожает сам металл, на выплавку которого были затрачены огромные усилия , ещё и выводит из строя готовые изделия, которые стоят дороже самого металла. Она ежегодно уничтожает десятки миллионов тонн выплавляемого металла. Железо при коррозии реагирует с кислородом и водой, превращаясь в ржавчину.
Железо, его положение в периодической системе химических элементов Д. И. Менделеева, взаимодействие с серой, хлороводородной кислотой, растворами солей.
ПЛАН ОТВЕТА:
положение в п. с. и строение атома физические свойства химические свойства Химический элемент железо находится в 4-ом периоде 8-ой группе побочной подгруппе. В атоме железа четыре электронных слоя. Электронами заполняется d–подуровень третьего слоя, на нём находится 6 электронов, а на четвёртом слое s–подуровне находится 2 электрона. В соединениях железо проявляет степени окисления +2 и +3.
| IV период VIII группа побочная подгруппа | Fe)))) | +2 | +3 | ||
| +26 2 8 8+6 2 | 4s | ?? | |||
| 3d | ?? | ? | ? | ? | ? |
Простое вещество железо – серебристо-белый металл с температурой плавления 15390С, плотностью 7,87 г/см3, обладает магнитными свойствами. Железо – химически активный металл. При нагревании оно взаимодействует с серой с образованием сульфида железа(II): Fe0 + S0 = Fe+2S-2. Железо вытесняет водород из растворов кислот, при этом образуются соли железа(II), например, при действии на железо соляной кислоты образуется хлорид железа(II): Fe0 + 2H+1Cl-1 = Fe+2Cl2-1 + H20. Железо может вытеснять менее активные металлы из растворов их солей, например, при действии железа на раствор сульфата меди(II) образуются металлическая медь и сульфат железа(II): Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4.
Во всех реакциях железо проявляет свойства восстановителя. Более сильные окислители – хлор, кислород, концентрированные кислоты – окисляют железо до степени окисления +3.
Если домашнее задание на тему: » Железо, его положение в периодической системе химических элементов Д И Менделеева, взаимодействие оказалось вам полезным, то мы будем вам признательны, если вы разместите ссылку на эту сообщение у себя на страничке в вашей социальной сети.
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.

Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.

В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу

Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.

Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс "Таблица Менделеева для чайников". В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Fe (лат. Ferrum), химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847. Блестящий серебристо-белый металл. Образует полиморфные модификации; при обычной температуре устойчиво a - Fe (кристаллическая решетка кубическая объемноцентрированная) с плотностью 7,874 г./см?. a - Fe вплоть до 769°С (точка Кюри) ферромагнитно; tпл 1535°С.
На воздухе окисляется покрывается рыхлой ржавчиной. По распространенности элементов в природе железо находится на 4-м месте; образует ок. 300 минералов. На долю сплавов железа с углеродом и другими элементами приходится около 95% всей металлической продукции (чугун, сталь, ферросплавы). В чистом виде практически не используется (в быту железными часто называются стальные или чугунные изделия). Необходимо для жизнедеятельности животных организмов; входит в состав гемоглобина.
Желемзо - элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) - ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро коррозирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8%), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес.% углерода) и чугун (более 2,14 вес.% углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом №1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре - 4,65% (4-е место после O, Si, Al). Считается также, что железо составляет бомльшую часть земного ядра.
Железо в трудах ученых
O том, что древние люди пользовались вначале именно железом метеоритного происхождения, свидетельствуют и распространенные у некоторых народов мифы о богах или демонах, сбросивших с неба железные предметы и орудия, - плуги, топоры и пр.
Интересен также факт, что к моменту открытия Америки индейцы и эскимосы Северной Америки не были знакомы со способами получения железа из руд, но умели обрабатывать метеоритное железо.
В древности и в средние века семь известных тогда металлов сопоставляли с семью планетами, что символизировало связь между металлами и небесными телами и небесное происхождение металлов. Такое сопоставление стало обычным более 2000 лет назад и постоянно встречается в литературе вплоть до XIX в.
Во II в. н.э. железо сопоставлялось с Меркурием и называлось меркурием, но позднее его стали сопоставлять с Марсом и называть марс (Mars), что, в частности, подчеркивало внешнее сходство красноватой окраски Марса с красными железными рудами.
Впрочем, некоторые народы не связывали название железа с небесным происхождением металла. Так, у славянских народов железо называется по «функциональному» признаку.
Русское железо (южнославянское зализо, польское zelaso, литовское gelesis и т.д.) имеет корень «лез» или «рез» (от слова лезо - лезвие). Такое словообразование прямо указывает на функцию предметов, изготовлявшихся из железа, - режущих инструментов и оружия.
Приставка «же», по-видимому, смягчение более древнего «зе» или «за»; она сохранилась в начальном виде у многих славянских народов (у чехов - zelezo).
Старые немецкие филологи - представители теории индоевропейского, или, как они его называли, индогерманского праязыка - стремились произвести славянские названия от немецких и санскритских корней.
Например, Фик сопоставляет слово железо с санскритским ghalgha (расплавленный металл, от ghal - пылать). Но вряд ли это соответствует действительности: ведь древним людям была недоступна плавка железа. С санскритским ghalgha скорее можно сопоставить греческое название меди, но не славянское слово железо.
Функциональный признак в названиях железа нашел отражение и в других языках. Так, на латинском языке наряду с обычным названием стали (chalybs), происходящим от наименования племени халибов, жившего на южном побережье Черного моря, употреблялось название acies, буквально обозначающее лезвие или острие.
Это, слово в точности соответствует древнегреческому, применявшемуся в том же самом смысле.
Упомянем в нескольких словах о происхождении немецкого и английского названий железа. Филологи обычно принимают, что немецкое слово Eisen имеет кельтское происхождение, так же как и английское Iron. В обоих терминах отражены кельтские названия рек (Isarno, Isarkos, Eisack), которые затем трансформировались) isarn, eisarn) и превратились в Eisen. Существуют, впрочем, и другие точки зрения.
Некоторые филологи производят немецкое Eisen от кельтского isara, означающего «крепкий, сильный». Существуют также теории, утверждающие, что Eisen происходит от ayas или aes (медь), а также от Eis (лед) и т.д. Староанглийское название железа (до 1150 г.) - iren; оно употреблялось наряду с isern и isen и перешло в средние века. Современное Iron вошло в употребление после 1630 г.
Заметим, что в «Алхимическом лексиконе» Руланда (1612) в качестве одного из старых названий железа приведено слово Iris, означающее «радуга» и созвучное Iron.
Ставшее международным, латинское название Ferrum принято у романских народов. Оно, вероятно, связано с греколатинским fars (быть твердым), которое происходит от санскритского bhars (твердеть). Возможно сопоставление и с ferreus, означающим у древних писателей «нечувствительный, непреклонный, крепкий, твердый, тяжкий», а также с ferre (носить). Алхимики наряду с Ferrum yпoтребляли и многие другие названия, например Iris, Sarsar, Phaulec, Mineraи др.
Железные изделия из метеоритного железа найдены в захоронениях, относящихся к очень давним временам (IV-V тысячелетиях до н.э.), в Египте и Месопотамии. Однако железный век в Египте начался лишь с ХIIв. до н.э., а в других странах еще позднее. В древнерусской литературе слово железо фигурирует в древнейших памятниках (с XI в.) под названиями желъзо, железо, железо.