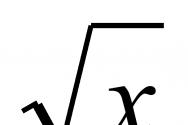Реакции солей аммония с щелочами. Химия для чайников.: Соли аммония. Примеры решения задач
Аммоний - одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.
Что такое аммоний
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH 3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.

Поэтому NH 3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:

Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак. Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония. Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
NH 3 + HCl = NH 4 Cl
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Аммоний хорошо взаимодействует с водой. В итоге реакции получаются гидраты аммиака усиленной концентрацией ОН - . Химическая запись реакции:
NH 3 + H 2 O → NH 4 + OH -
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH 4 OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH 4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
Соли NH 4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
NH 4 Cl= NH 4 + + HCl -
Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты :
Имеют ионную кристаллическую решетку, обладают электропроводимостью;
Не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
Распад солей аммония под воздействием температур может быть необратим, либо же представлять собой обратимый процесс. Если анион соли проявляет несильные свойства окислителя, соли распадается обратимо. Классическим примером такой реакции является хлорид аммония: при повышении температуры реакции он в конце концов распадается на собственные исходные элементы - хлористый водород, а также аммиак. Если стенки сосуда не прогревать, на них появляется налет. Так генерируется хлорид аммония.

Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
NH 4 NO 3 = N 2 O + H 2 O
Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
Азотистые удобрения
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно - это сульфат аммония, нитрат аммония, хлорид аммония. Азот - необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма. Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты. Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений. Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.

Почвы в естественной среде содержат незначительное количество азота. После сбора каждого урожая вместе с растениями уносится и то малое количество азота, которое прежде находилось в земле. Чтобы ускорить процесс регенерации почвы, и применяются азотистые удобрения.
Сульфат аммония. Формула этого соединения - (NH4) 2 SO 4. Эта соль аммония служит основой для множества удобрений.
Нитрат аммония. Формула этого вещества - NH 4 NO 3 . Это также известное удобрение, которое хорошо усваивается растениями. Кроме сельскохозяйственного применения, нитрат аммония используется в военной и горнодобывающей отрасли - на его основе изготавливаются взрывчатые смеси (аммоналы), применяемые для подрывных работ.

Нашатырь
Хлорид аммония. Хорошо известен, как нашатырь. Его химическая формула - NH 4 Cl. Это соединение хорошо известно в производстве лакокрасочной продукции, в текстильном деле, используется нашатырь и в гальванических элементах. Хорошо известен хлорид аммония пайщикам и лудильщикам. В своей работе они часто задействуют хлористые соли аммония. Применение этого вещества помогает удалить с поверхности металлов тончайшие оксидные пленки. Прикосновение разогретого металла к нашатырю вызывает соответствующую реакцию оксидов - они либо переходят в хлориды, либо восстанавливаются. Хлориды быстро улетучиваются с поверхности металла. Процесс реакции для меди может быть записан следующим образом:
4CuO + 2 NH 4 Cl = 3Cu + 2CuCl 2 + N 2 +4H 2 O.
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений - содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
Страница 1
Соли аммония - соли, содержащие положительно заряженый ион аммония NH4+; по строению, цвету и другим свойствам они похожи на соответствующие соли калия. Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются. Получают их при взаимодействии NH3 или NH4OH с кислотами.
Применение
Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ - аммонитов;
Сульфат аммония (NH4)2SO4 - как дешёвое азотное удобрение;
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 - в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
Хлорид аммония (нашатырь) NH4Cl - в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
Химические свойства солей
Сильные электролиты (диссоциируют в водных растворах):
NH4Cl ↔ NH4+ + Cl−
Разложение при нагревании:
а) если кислота летучая
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O
(NH4)2Cr2O7 → N2 + Cr2O3+ 4Н2O
С кислотами (реакция обмена):
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32− + 2H+ + 2Cl− → 2NH4+ + 2Cl− + Н2O + CO2
CO32− + 2H+ → Н2O + CO2
C солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42− + Ba2+ + 2NO3− → BaSO4 ↓ + 2NH4+ + 2NO3−
Ba2+ + SO42− → BaSO4 ↓
Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) - среда кислая:
NH4Cl + Н2O ↔ NH4OH + HCl
NH4+ + Н2O ↔ NH4OH + H+
При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония)
NH4Cl + NaOH → NaCl + NH3 + Н2O
Железодефицитная анемия (ЖДА) - гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией и сидеропенией. Основными причинами ЖДА являются кровопотери и недостаток богатой гемом пищи - мяса и рыбы.
Лечение проводится только длительным приёмом препаратов двухвалентного железа внутрь в умеренных дозах, причём существенный прирост гемоглобина, в отличие от улучшения самочувствия, будет не скорым - через 4-6 недель.
Обычно назначается любой препарат двухвалентного железа - чаще это сульфат железа - лучше его пролонгированная лекарственная форма, в средней лечебной дозе на несколько месяцев, затем доза снижается до минимальной ещё на несколько месяцев, а затем (если причина малокровия не устранена), продолжается приём поддерживающей минимальной дозы в течение недели ежемесячно многие годы. Так, эта практика хорошо оправдала себя при лечении тардиферроном женщин с хронической постгеморрагической железодефицитной анемией вследствие многолетней гиперполименорреи - одна таблетка утром и вечером 6 месяцев без перерыва, затем одна таблетка в день ещё 6 месяцев, затем несколько лет каждый день в течение недели в дни месячных. Это дисциплинирует пациенток, не даёт забыть сроки приёма препарата и обеспечивает нагрузку железом при появлении затянутых обильных месячных в период климакса. Бессмысленным анахронизмом является определение уровня гемоглобина до и после месячных.
В химических соединениях NH4+ проявляет себя как положительный однозарядный катион щелочного металла. При взаимодействии с кислотными анионами образуются вещества c кристаллической структурой - соли NH4N03, хлорид NH4C1, сульфат (NH4)2S04, которые состоят из аниона кислоты и аммонийной группы.
Соли аммония получают в ходе которая осуществляется в процессе взаимодействия аммиака с кислотами.
Соли аммония, как, в принципе, большинство щелочных металлов, могут диссоциировать (расщепляться на катионы и анионы) в водных растворах на ионы: аммонийные соли, как и соли щелочных металлов, диссоциируют на ионы:
NH4N03 ↔ NH4++ NO3-
В процессе нагревания сухие аммонийные соли разлагаются на аммиак и кислоту; данный процесс еще называют термической диссоциацией.
Образовавшаяся кислота (например, хлористоводородная кислота) вместе с NH3 улетучивается, а при охлаждении соединяется с аммиаком и получается соль. Следует сказать, что возможен и процесс обратимого разложения:
NH3 + HCl ↔ NH4Cl
Таким образом, при нагревании нашатырь возгоняется, однако, через некоторое время на верхних частях пробирки снова появляется белый налет хлорида аммония. В результате образования соли нелетучей кислотой, например, (NH4)2S04, во время нагревания улетучивается только NH3, а кислота остается. Такой процесс называется необратимым разложением.
Все соли аммония хорошо разлагаются щелочами (при нагревании) с выделением аммиака:
NH4+ + ОН -↔NH3+ Н20
Эту реакцию используют для распознавания минеральных удобрений с аммонийной формой азота.
При взаимодействии карбоната аммония с минеральными и выделяется диоксид карбона. При взаимодействии сульфат или хлорид аммония с AgNO3 или BaCl образуются характерные осадки, белого цвета.
Соли аммония: примеры
Аммонийные солишироко применяются в сельском хозяйстве. Это прекрасный материал для минеральной подкормки растений (например, сульфат аммония - (NH4)2S04). Как известно нитроген растения могут усваивать только в связанном виде (NO3, NH4). Поэтому азотистые соединения являются очень эффективными. Огромное значение имеет нитрат аммония, который содержит аммонийный NH4 нитратный NO3- азот.
Дигидрофосфат и гидрофосфат аммония, известные под названиями аммофоса NH4H2P04 и диаммофоса (NH4)2НР04, содержат два химических элемента питания растений — нитроген и фосфор. Соли аммония входят в состав тукосмесей.
При взаимодействии аммиака с оксидом карбона (IV) синтезируют мочевину или карбамид NH2-CO-NH2.
Хлорид аммония (NH4C1) или нашатырь используют в гальванических элементах, при крашении и ситцепечатании, лужении и паянии. Контактируя с нагретым металлом, нашатырь разлагается на хлористый водород и аммиак. взаимодействует с оксидом, загрязняющим поверхность металла, при этом образовывается летучая соль.
Следует обратить внимание, что к очищенной поверхности очень хорошо пристает припой. NH4NO3 (нитрат аммония) вместе с углем и солями алюминия являются составной частью взрывчатого вещества - аммонала. Указанные соединения используют при разработке горных пород. (NH4НСО3) очень часто применяют в пищевой и кондитерской промышленности. Это соединение также используют как консервант для разных видов кормов. NH4HCO3 обладает денитрофицирующими свойствами, что способствует ускорению созревания урожая.
Качественная реакция на соли аммония. При нагревании раствора солей аммония со щелочами образуется который расщепляется с выделением аммиака.
О наличии аммиака можно судить по специфическому запаху, а также с помощью цветных бумажных индикаторов. Для проведения этой реакции необходимо взять 1,0 см3 раствора соли аммония добавить 0,5 см3 раствора и нагреть. В процессе нагревания выделяется аммиак, образуется характерный запах, красный лакмус синеет.
Основа солей аммония – аммиак. Применяется он при производстве многих органических веществ. В целом можно утверждать, что полезность аммонийных солей стоит на одном уровне с полезностью пищевой соли.
Из всех областей применения солей аммония особое внимание стоит обратить на их применение в народной медицине. Самая распространённая соль аммония – . Применяют его в народе в виде 10% спиртового раствора. Действие этого раствора основано на мощном раздражении нервных окончаний верхних дыхательных путей.
Применяется действие в основном для приведения человека в сознательное состояние. Его можно применять и для того, чтобы пробудить во время естественного сна, быстро вывести из обморочного состояния. В меньшей степени нашатырь эффективен при отравлениях угарным газом, при утоплениях и удушениях, т.к. здесь сложно определить момент, когда средства местного действия уже не эффективны.
Применяют нашатырный спирт следующим способом. На кусочек ваты (бинта, салфетки) наносят несколько капель спирта и подносят к носу пострадавшего на расстоянии 0.5–1 см на 1–2 минуты.
Отдельной статьёй применения нашатырного спирта считается экстренное чрезмерно употребивших алкогольную продукцию людей. Во многих случаях при отравлении алкоголем используют водный раствор нашатыря. Рецепт этот прост: на стакан воды добавляют 5–6 капель нашатыря и дают выпить человеку, которого надо привести в чувство.
По сравнению с более привычными средствами, такими, как поливание водой или растирание ушей, этот способ позволяет не только разбудить, но и полностью отрезвить человека, он становится способен складно излагать свои мысли, отвечать на вопросы.
Нашатырный спирт
Нашатырный спирт может использоваться для стерилизации, например, иголки, которой планируется извлекать занозу из пальца. Достаточно протереть ее ваткой, смоченной в спирте или окунуть её на несколько секунд во флакон с ним.
В неразбавленном состоянии нашатырный спирт рекомендуют применять в качестве прижигающего средства для выведения папиллом. Для этого берут ватную палочку, обмакивают её в спирт и прижимают к участку кожи с папилломой на 5–6 секунд. Важно, чтобы спирт не попал на здоровую кожу, иначе можно получить химический ожог.
А если разбавить его в 10 раз, то он очень хорошо помогает избавиться от зуда в местах укуса насекомых или при ожогах
>> Химия: Соли аммония
Как было сказано, катион аммония NH4+ играет роль катиона металла и он образует с кислотными остатками соли: NH4NO3 - нитрат аммония, или аммиачная селитра, (NН4)2SO4 - сульфат аммония и т. д.
Все соли аммония - твердые кристаллические вещества, хорошо растворимые в воде. По ряду свойств они похожи на соли щелочных металлов, и в первую очередь на соли калия, так как радиусы ионов К+ и NН+ приблизительно равны.
Соли аммония получают взаимодействием аммиака или его водного раствора с кислотами.
Они обладают всеми свойствами солей, обусловленными наличием кислотных остатков. Например, хлорид или сульфат аммония реагирует соответственно с нитратом серебра или хлоридом бария, образуя при этом характерные осадки. Карбонат аммония взаимодействует с кислотами, так как в результате реакции образуется углекислый газ .
Кроме того, ион аммония обусловливает другое, общее для всех солей аммония, свойство: его соли реагируют со щелочами при нагревании с выделением аммиака.
Эта реакция является качественной реакцией на соли аммония, так как образующийся аммиак легко обнаруживается (как именно?).
Третья группа свойств солей аммония - это их способность разлагаться при нагревании с выделением газообразного аммиака, например:
NH4Сl = NH3 + НСl
В этой реакции образуется также газообразный хлороводород, который улетучивается вместе с аммиаком, а при охлаждении вновь соединяется с ним, образуя соль, т. е. при нагревании в пробирке сухой хлорид аммония как бы возгоняется, но на верхних холодных стенках пробирки снова появляются белые кристаллики NН4Сl (рис. 32).
Основные области применения солей аммония были показаны ранее, на рисунке 31. Здесь обратим ваше внимание на то, что почти все соли аммония используют в качестве азотных удобрений. Как вы знаете, растения способны усваивать азот только в связанном виде, т. е. в виде ионов NН4 или N03. Замечательный русский агрохимик Д. Н. Прянишников выяснил, что если у растения есть выбор, то оно предпочитает катион аммония нитрат-аниону, поэтому использование солей аммония в качестве азотных удобрений особенно эффективно. Очень ценным азотным удобрением является нитрат аммония NH4NO3.
Отметим другие области применения некоторых солей аммония.
Хлорид аммония NН4Сl используют при паянии, так как он очищает поверхность металла от оксидной пленки и к ней хорошо пристает припой.
Гидрокарбонат аммония NН4NС03 и карбонат аммония (NH4)2С03 применяют в кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
NH4НС03 = NH3 + Н20 + CO2
Нитрат аммония NН4NO3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества - аммонала, который широко применяется при разработке горных пород.
1. Соли аммония.
2. Свойства солей аммония, обусловленные ионом аммония, кислотных остатков. Разложение солей аммония.
3. Качественная реакция на ион аммония.
4. Хлорид, нитрат, карбонат аммония и их применение.
Напишите уравнения реакций (в молекулярной и ионной формах) между следующими парами веществ: а) сульфат аммония и хлорид бария; б) хлорид аммония и нитрат серебра.
Напишите уравнения реакций, характеризующих свойства карбоната аммония: взаимодействие с кислотой, щелочью, солью и реакцию разложения. Первые три уравнения запишите также в ионной форме.
С многоосновными кислотами аммиак образует не только средние, но и кислые соли. Напишите формулы кислых солей, которые он может дать при взаимодействии с фосфорной кислотой. Назовите их и напишите уравнения диссоциации этих солей.
Составьте молекулярные и, где это возможно, ионные уравнения реакций, с помощью которых можно осуществить следующие переходы:
N2 -> NH3 -> (NH4)2 HPO4 -> NH4Cl -> NH4NO3
Определите количество вещества, объем и массу аммиака , необходимого для получения 250 кг сульфата аммония, используемого в качестве удобрения.
Содержание урока конспект урока опорный каркас презентация урока акселеративные методы интерактивные технологии Практика задачи и упражнения самопроверка практикумы, тренинги, кейсы, квесты домашние задания дискуссионные вопросы риторические вопросы от учеников Иллюстрации аудио-, видеоклипы и мультимедиа фотографии, картинки графики, таблицы, схемы юмор, анекдоты, приколы, комиксы притчи, поговорки, кроссворды, цитаты Дополнения рефераты статьи фишки для любознательных шпаргалки учебники основные и дополнительные словарь терминов прочие Совершенствование учебников и уроков исправление ошибок в учебнике обновление фрагмента в учебнике элементы новаторства на уроке замена устаревших знаний новыми Только для учителей идеальные уроки календарный план на год методические рекомендации программы обсуждения Интегрированные уроки