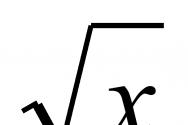Что вызывает денатурацию белков. Денатурация белков, типы денатурации. Факторы, вызывающие денатурацию белков
Денатурация – это нарушение нативной пространственной структуры белковой молекулы под влиянием внешних воздействии.
К числу таких внешних воздействий можно отнести нагревание (тепловая денатурация); встряхивание, взбивание и другие резкие механические воздействия (поверхностная денатурация); высокую концентрацию водородных или гидроксильных ионов (кислотная или щелочная денатурация); интенсивную дегидратацию при сушке и замораживании продуктов и др.
Для технологических процессов производства продукции общественного питания наибольшее практическое значение имеет тепловая денатурация белков. При нагревании белков усиливается тепловое движение атомов и полипептидных цепей в белковых молекулах, в результате чего разрушаются так называемые слабые поперечные связи между полипептидными цепями (например, водородные), а также ослабляются гидрофобные и другие взаимодействия между боковыми цепями. В результате этого изменяется конформация полипептидных цепей в белковой молекуле. У глобулярных белков развертываются белковые глобулы с последующим свертыванием по новому типу; прочные (ковалентные) связи белковой молекулы (пептидные, дисульфидные) при такой перестройке не нарушаются. Тепловую денатурацию фибриллярного белка коллагена можно представить в виде плавления, так как в результате разрушения большого числа поперечных связей между полипептидными цепями фибриллярная структура его исчезает, а коллагеновые волокна превращаются в сплошную стекловидную массу.
В молекулярной перестройке белков при денатурации активная роль принадлежит воде, которая участвует в образовании новой конформационной структуры денатурированного белка. Полностью обезвоженные белки, выделенные в кристаллическом виде, очень устойчивы и не денатурируют даже при длительном нагревании до температуры 100 °С и выше. Денатурирующий эффект внешних воздействий тем сильнее, чем выше гидратация белков и ниже их концентрация в растворе.
Денатурация сопровождается изменениями важнейших свойств белка: потерей биологической активности, видовой специфичности, способности к гидратации (растворению, набуханию); улучшением атакуемости протеолитическими-ферментами (в том числе пищеварительными); повышением реакционной способности белков; агрегированием белковых молекул.
Потеря белками биологической активности в результате их тепловой денатурации приводит к инактивации ферментов, содержащихся в растительных и животных клетках, а также к отмиранию микроорганизмов, попадающих в продукты в процессе их производства, транспортирования и хранения. В целом этот процесс оценивается положительно, так как готовую продукцию при отсутствии ее повторной обсемененности микроорганизмами можно хранить сравнительно продолжительное время (в охлажденном или мороженом виде).
В результате потери белками видовой специфичности пищевая ценность продукта не снижается. В ряде случаев это свойство белков используется для контроля технологического процесса. Например, по изменению окраски хромопротеида мяса – миоглобина с красной на светлокоричневую судят о кулинарной готовности большинства мясных блюд.
Потеря белками способности к гидратации объясняется тем, что при изменении конформации полипептидных цепей на поверхности молекул белка появляются гидрофобные группы, а гидрофильные оказываются блокированными в результате образования внутримолекулярных связей.
Улучшение гидролиза денатурированного белка протеолитическими ферментами, повышение его чувствительности к многим химическим реактивам объясняется тем, что в нативном белке пептидные группы и многие функциональные (реакционноспособные) группы экранированы внешней гидратной оболочкой или находятся внутри белковой глобулы и таким образом защищены от внешних воздействий.
При денатурации указанные группы оказываются на поверхности белковой молекулы.
Агрегирование – это взаимодействие денатурированных молекул белка, в результате которого образуются межмолекулярные связи, как прочные, например, дисульфидные, так и многочисленные слабые.
Следствием агрегирования белковых молекул является образование более крупных частиц. Последствия дальнейшего агрегирования частиц белка различны в зависимости от концентрации белка в растворе. В малоконцентрированных растворах образуются хлопья белка, выпадающие в осадок или всплывающие на поверхность жидкости (часто с образованием пены). Примерами агрегирования такого типа являются выпадение в осадок хлопьев денатурированного лактоальбумина (при кипячении молока), образование хлопьев и пены белков на поверхности мясных и рыбных бульонов. Концентрация белков в этих растворах не превышает 1% .
При денатурации белков в более концентрированных белковых растворах в результате их агрегирования образуется сплошной студень, удерживающий всю содержащуюся в системе воду. Такой тип агрегирования белков наблюдается при тепловой обработке мяса, рыбы, яиц и различных смесей на их основе. Оптимальная концентрация белков, при которой белковые растворы в условиях нагревания образуют сплошной студень, неизвестна. Принимая во внимание, что способность к студнеобразованию у белков зависит от конфигурации (асимметрии) молекул, надо полагать, что для разных белков указанные пределы концентраций различны.
Белки в состоянии более или менее обводненных студней при тепловой денатурации уплотняются, т.е. происходит их дегидратация с отделением жидкости в окружающую среду. Студень, подвергнутый нагреванию, как правило, имеет меньшие объем, массу, пластичность, а также повышенную механическую прочность и большую упругость по сравнению с исходным студнем нативных белков. Эти изменения также являются следствием агрегирования молекул денатурированных белков. Реологические характеристики таких уплотненных студней зависят от температуры, рН среды и продолжительности нагревания.
Денатурация белков в студнях, сопровождающаяся их уплотнением и отделением воды, происходит при тепловой обработке мяса, рыбы, варке бобовых, выпечке изделий из теста.
Каждый белок имеет определенную температуру денатурации. В пищевых продуктах и полуфабрикатах обычно отмечают низший температурный уровень, при котором начинаются видимые денатурационные изменения наиболее лабильных белков. Например, для белков рыбы эта температура составляет около 30 С, яичного белка – 55 С.
При значениях рН среды, близких к изоэлектрической точке белка, денатурация происходит при более низкой температуре и сопровождается максимальной дегидратацией белка. Смещение рН среды в ту или иную сторону от изоэлектрической точки белка способствует повышению его термостабильности. Так, выделенный из мышечной ткани рыб глобулин X, который имеет изоэлектрическую точку при рН 6,0, в слабокислой среде (рН 6,5) денатурирует при 50 °С, в нейтральной (рН 7,0) – при 80 °С.
Реакция среды влияет и на степень дегидратации белков в студнях при тепловой обработке продуктов. Направленное изменение реакции среды широко используется в технологии для улучшения качества блюд. Так, при припускании птицы, рыбы, тушении мяса, мариновании мяса и рыбы перед жаркой добавляют кислоту, вино или другие кислые приправы для создания кислой среды со значениями рН, лежащими значительно ниже изоэлектрической точки белков продукта. В этих условиях дегидратация белков в студнях снижается и готовый продукт получается более сочным.
В кислой среде набухает коллаген мяса и рыбы, снижается его температура денатурации, ускоряется переход в глютин, в результате чего готовый продукт получается более нежным.
Температура денатурации белков повышается в присутствии других, более термостабильных белков и некоторых веществ небелковой природы, например сахарозы. Это свойство белков используют, когда при тепловой обработке возникает необходимость повысить температуру смеси (например, в целях пастеризации), не допуская денатурации белков. Тепловая денатурация некоторых белков может происходить без видимых изменений белкового раствора, что наблюдается, например, у казеина молока.
Пищевые продукты, доведенные тепловой обработкой до готовности, могут содержать большее или меньшее количество нативных, неденатурированных белков, в том числе некоторых ферментов.
Денатурация белков. Под влиянием физических (температура, ультразвук, ионизирующая радиация и т.п.), химических (минеральные и органические кислоты, щелочи, органические растворители, тяжелые металлы,
алкалоиды, детергенты, некоторые амиды, например, мочевина и др.). Факторов происходят глубокие изменения в молекуле белка, связанные с нарушением четвертичной, третичной и вторичной структур, что приводит в свою очередь изменение физико-химических и биологических свойств белка, т.е. денатурацию. При денатурации белка имеет место разрыв цементирующих белковую молекулу вторичных связей (водородных, дисульфидных, электростатических, ван-дер-ваальсовых и др..). Это приводит к изменению пространственной структуры; глобула белка раскручивается, на ее поверхности увеличивается количество гидрофобных групп, то есть уменьшаются гидрофильные свойства белка. Он становится более гидрофобным, теряет способность растворяться в обычных для него растворителях и избавляется от своих биологических функций (ферментов, гормонов и др.). После денатурации изменяется большинство физико-химических свойств белка: уменьшается растворимость, увеличивается количество БН-и других групп, усиливается вязкость, появляется больше хиральных атомов углерода, изменяются оптические свойства и константа седиментации. В структуре белка существенно уменьшается количество а-спиралей и ß-структур, уменьшается количество внутримолекулярных водородных связей и увеличивается количество этих связей между белком и водой. При денатурации белка высвобождаются реактивные группы, которые в его нативной-м состоянии были не совсем доступны (сульфгидрильные, фенольные, гидроксильные, имидазольным и др.)., Что вызывает изменение ИЭТ белков. Чаще всего она смещается в сторону щелочных значений рН. Денатурация белков сопровождается ростом оптической активности. Преобразование компактной молекулы в беспорядочный клубок, которое имеет место при денатурации, приводит к тому, что большинство пептидных связей становятся доступными для действия протеолитических ферментов (трипсина, химотрипсина и др.).. В связи с этим протеолиз таких белков происходит с большей скоростью, чем нативных белков.
При денатурации в большинстве случаев первичная структура не нарушается, поэтому после раскрутки полипептидной цепи (стадия нити) он может снова стихийно скручиваться, образуя «случайный клубок», т.е. переходит к хаотическому состоянию (рис. 18). При этом наблюдается агрегация белковых частиц и выпадение их в осадок.
Полная денатурация белка в большинстве случаев необратима, в отличие от оборотной, при которой изменения в молекуле белка незначительные, и белок при определенных условиях снова приобретает свои нативных свойств (процесс ренатурации). Например, такое происходит во время осаждения белков органическими растворителями - спиртом или ацетоном, если проводить его при низкой температуре, а затем быстро удалить осадитель. Процесс денатурации белков широко используется в клинике, фармации и биохимических исследованиях для осаждения белка в биологическом материале с целью дальнейшего определения в нем небелковые-вых и низкомолекулярных соединений, для установления наличия белка и его количественного определения, для обеззараживания кожи и слизистых покровов, для свя Связывание солей тяжелых металлов при лечении отравлений солями ртути, свинца, меди и т.п. или для профилактики таких отравлений на предприятии.
Процесс денатурации белков имеет место во время приема фармпрепаратов танина и Танальбин, на чем основывается их вяжущее и противовоспалительное действие. Вяжущее действие танина обусловлено его способностью осаждать белки с образованием плотных альбуминаты, которые защищают от раздражения чувствительные нервные окончания тканей. При этом уменьшаются болевые ощущения и происходит непосредственное уплотнение клеточных мембран, уменьшает проявление воспалительной реакции. Препарат танальбин-продукт взаимодействия танина с белком казеином - в отличие от танина не оказывает вяжущего действия на слизистую оболочку рта и желудка. Только после поступления в кишечник он расщепляется, выделяя свободный танин. Применяется как вяжущее средство при острых и хронических заболеваниях кишечника, особенно у детей.
Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, то есть выступать в роли амфотерных электролитов. Белки активно вступают в химические реакции. Это свойство связано с тем, что аминокислоты, входящие в состав белков, содержат разные функциональные группы, способные реагировать с другими веществами. Белки обладают большим сродством к воде, то есть они гидрофильны. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы. Гидролиз - под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
Денатурация – утрата белковой молекулы структурной организации (вторичного, третичного, четвертичного). Может быть вызвана изменением температуры, обезвоживанием, облучением, изменением рН среды и др. Денатурация бывает обратимой и необратимой. Обратимая денатурация не затрагивает первичную структуру. При необратимой денатурации разрушается первичная структура. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается и структура белка - ренатурация.
Функции белков в клетке.
Одна из важнейших функций белков в клетке - строительная : белки участвуют в образовании всех клеточных мембран в органоидах клетки, а также внеклеточных структур. Исключительно важное значение имеет каталитическая функция белков. Все биологические катализаторы - ферменты - вещества белковой природы. Они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. Фермент катализирует только одну реакцию, т.е. он узкоспецифичен. Высокая специфичность ферментативных реакций обусловлена тем, что пространственная конфигурация активного центра фермента, т.е. участка белка, который связывает какую-либо молекулу, точно соответствует конфигурации этой молекулы. Двигательная функция организма обеспечивается сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: мерцание ресничек и биение жгутиков у простейших, сокращение мышц у животных. Транспортная функция белков заключается в присоединения химических элементов (например, кислорода) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела. При поступлении в организм чужеродных белков или микроорганизмов в белых кровяных тельцах - лейкоцитах - образуются особые белки - антитела. Они связывают и обезвреживают несвойственные организму вещества. В этом выражается защитная функция белков. Белки служат и одним из источников энергии в клетке, т. е, выполняют энергетическую функцию. При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.
Ферменты. Основные свойства ферментативных процессов.
Ферменты, или энзимы - обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах, специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов.Все реакции с участием ферментов протекают, в основном, в нейтральной, слабощелочной или слабокислой среде. Однако максимальная активность каждого отдельного фермента проявляется при строго определенных значениях pH. Для действия большинства ферментов теплокровных животных наиболее благоприятной температурой является 37-40С. У растений при температуре ниже 0С. Действие ферментов полностью не прекращается, хотя жизнедеятельность растений при этом резко снижается. Ферментативные процессы, как правило, не могут протекать при температуре выше 70С, так как ферменты, как и всякие белки подвержены тепловой денатурации (разрушению структуры).
Строение ферментов.
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата (Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е)) и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
В свою очередь в активном центре выделяют два участка:
якорный (контактный, связывающий, адсорбционный центр) – отвечает за связывание и ориентацию субстрата в активном центре,
каталитический – непосредственно отвечает за осуществление реакции.
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Свойства и функции белков
Структура и свойства белков могут изменяться под влиянием разных физико-химических факторов: действие концентрированных кислот и щелочей, тяжелых металлов, изменение температуры и т. п. Одни из белков легко изменяют структуру под незначительным действием разнообразных факторов, другие – стойкие к подобным влияниям. Основные свойства белка это – денатурация, ренатурация, деструкция.
Денатурация
Денатурация – это процесс нарушения естественной структуры белка с сохранением пептидных связей (первичной структуры). Может быть необратимым процессом. Но при условии прекращения действия отрицательных факторов на первых стадиях белок может восстанавливать свое нормальное состояние, то есть происходит обратная денатурация – ренатурация.
Ренатурация
Ренатурация – это способность белка восстанавливать нормальную структуру после устранения действия отрицательных факторов. Выполнение некоторых функций – двигательной, сигнальной, каталитической и т. п. – у живых организмов связано с частичной обратной денатурацией белков.
Деструкция
Деструкция – это процесс разрушения первичной структуры белка. Является всегда процессом необратимым.
Функции белков
Белки выполняют следующие основные функции:
- Структурная (строительная) . Входят в состав мембран, микротрубочек и микронитей, которые выполняют роль цитоскелета. В связях содержится белок эластин, в волосах, ногтях и перьях – белок кератин, в хрящах и сухожилиях – белок коллаген, в костях – белок осеин.
- Защитная . Лимфоцитами вырабатываются специализированные белки – антитела, которые способны распознавать и обезвреживать бактерии, вирусы, инородные для организма белки. В процессах свертывания крови принимают участие белки фибрин, тромбопластин и тромбин. Они предупреждают значительные потери крови. В ответ на атаку болезнетворных микроорганизмов растения также синтезируют ряд защитных белков.
- Сигнальная . Обеспечивает избирательное поглощение клеткой определенных веществ и способствует защите ее. При этом отдельные сложные белки клеточных мембран способны распознавать определенные химические соединения и реагировать на них. Они связываются с ними или изменяют свою структуру и передают сигналы об этих веществах на другие участки мембраны или вглубь клетки.
- Двигательная (сократительная) . Обеспечивают способность клетки двигаться, изменять форму. Например, сокращающиеся белки актин и миозин функционируют в скелетных мышцах и во многих других клетках. В состав микротрубочек ресничек и жгутиков эукариотических клеток входит белок тубулин.
- Регуляторная . Являются гормонами белковой природы у животных, регулирующими рост, половое созревание, половые циклы, изменение покровов и т. п. Некоторые белки регулируют активность обмена веществ.
- Транспортная . Белки транспортируют неорганические ионы, газы (кислород, углекислый газ), специфические органические вещества. Транспортные белки содержатся в мембранах клеток, в эритроцитах и т. п. В крови есть белки-транспортеры, которые узнают и связывают определенные гормоны и несут их к определенным клеткам. Например, гемоцианин (белок синего цвета) у беспозвоночных, гемоглобин у позвоночных переносят кислород.
- Запасающая . Могут запасаться в эндосперме семени многих иидов растений (в злаковых от 15-25 %, бобовых – до 45 %), в яйцах птиц, пресмыкающих и т. п.
- Питательная . Зародыш семени некоторых растений потребляет на первых этапах развития белки, которые отложены в запас.
- Энергетическая . При расщеплении белков высвобождается энергия. Аминокислоты, которые образовались при расщеплении белков, или используются для биосинтеза белков, нужных организму, или раскладываются с высвобождением энергии. При полном расщеплении 1 г белков в среднем высвобождается 17,2 кДж энергии. Однако белки как источник энергии используются очень редко, преимущественно тогда, когда истощаются запасы углеводов и жиров.
- Ферментативная (каталитическая) . Эту функцию выполняют белки – ферменты, которые ускоряют биохимические реакции в организме.
- Функция антифриза . В плазме крови некоторых живых организмов содержатся белки, которые предупреждают ее замерзание в условиях низких температур.
Некоторые организмы, живущие в горячих условиях, имеют белки, которые не денатурируют даже при температуре +50…90 °С.
Некоторые белки образуют сложные комплексы с пигментами, нуклеиновыми кислотами.
Для обозначения процесса, при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
Факторы, вызывающие денатурацию белков
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические .
Физические факторы
1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-50 0 С. Такие белки называют термолабильными . Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными .
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
4. Ультразвук
5. Механическое воздействие (например, вибрация).
Химические факторы
1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (например, CuSO 4).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
5. Другие вещества, способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Обратимость денатурации
В пробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
In vivo, в организме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации. Такие специфические белки известны как «белки теплового шока » или «белки стресса ».
Белки стресса
Существует несколько семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех клетках организма. Они выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул. Перечисленные функции белков стресса называются шаперонными . При различных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-44 0 С), при вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Молекула белка теплового шока состоит из двух компактных глобул, соединенных свободной цепью:
 Разные
белки теплового шока имеют общий план
построения. Все они содержат контактные
домены.
Разные
белки теплового шока имеют общий план
построения. Все они содержат контактные
домены.
Разные белки с различными функциями могут содержать одинаковые домены. Например, различные кальций-связывающие белки имеют одинаковый для всех них домен, отвечающий за связывание Ca +2 .
Роль доменной структуры заключается в том, что она предоставляет белку большие возможности для выполнения своей функции благодаря перемещениям одного домена по отношению к другому. Участки соединения двух доменов – самое слабое в структурном отношении место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз связей, и белок разрушается.