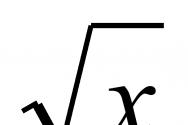Окисление аминокислот. Окислительное расщепление аминокислот. Пути обезвреживания аммиака в тканях животных
Аминокислоты, белки и пептиды являются примерами соединений, описанных далее. Многие биологически активные молекулы включают несколько химически различных функциональных групп, которые могут взаимодействовать между собой и с функциональными группа друг друга.
Аминокислоты.
Аминокислоты - органические бифункциональные соединения, в состав которых входит карбоксильная группа -СООН , а аминогруппа - NH 2 .
Разделяют α и β - аминокислоты:
В природе встречаются в основном α -кислоты. В состав белков входят 19 аминокислот и ода иминокислота (С 5 Н 9 NO 2 ):


Самая простая аминокислота - глицин. Остальные аминокислоты можно разделить на следующие основные группы:
1) гомологи глицина - аланин, валин, лейцин, изолейцин.
Получение аминокислот.
Химические свойства аминокислот.
Аминокислоты - это амфотерные соединения, т.к. содержат в своём составе 2 противоположные функциональные группы - аминогруппу и гидроксильную группу. Поэтому реагируют и с кислотами и с щелочами:
Кислотно-основные превращение можно представить в виде:
В первом разделе данной главы уже охарактеризована необходимость и основная стратегия расщепления аминокислот. Она объясняется невозможностью запасания аминокислот впрок и невозможностью их выведения из клеток целиком. Избыточные аминокислоты используются организмами как метаболическое топливо : их углеродные скелеты при перестройках определенного рода могут вовлекаться в биосинтез жирных кислот, глюкозы, кетоновых тел, изопреноидов и др., а также окисляться в ЦТК, обеспечивая клетку энергией. Следует отметить, что многие микроорганизмы, в частности аэробные бактерии, способны использовать отдельные аминокислоты в качестве единственного источника энергии и углерода. У анаэробных микроорганизмов, при отсутствии в клетках цикла трикарбоновых кислот, выработался другой механизм: катаболизм аминокислот в парах, когда одна из них служит донором электронов, а вторая-акцептором. Важно, что в таком процессе происходит образование АТР.
Кроме углеродных скелетов, при деградации аминокислот образуется аминный азот, который в отличие от углерода не пригоден для получения энергии за счет окисления, и более того, является токсичным для клеток. Поэтому те аминогруппы, которые не могут повторно использоваться в биосинтезе, превращаются в мочевину (или другие вещества) и выводятся из организма.
Ниже будут рассмотрены основные типы реакций, в которые могут вступать аминокислоты: реакции по a-аминогруппе, карбоксильной группе и боковой цепи.
Расщепление аминокислот по аминогруппе . Эти процессы представлены в основном реакциями трансаминирования и дезаминирования по a-аминогруппе. Реакции трансаминирования уже были рассмотрены в разделе, касающемся биосинтеза аминокислот. Они катализируются трансаминазами (аминотрансферазами), отличительной особенностью которых является использование пиридоксальфосфата (производное витамина В 6) в качестве простетической группы. Наибольшее значение в процессах деградации аминокислот имеют глутамат-трансаминаза и аланин-трансаминаза. Эти ферменты выполняют роль «воронок», собирающих аминогруппы от разных аминокислот и включающих их в состав глутамата и аланина. У животных эти две аминокислоты служат переносчиками накапливающегося аминного азота из тканей в печень. В печени аминогруппа аланина переносится аланинтрансаминазой на a-кетоглутарат с образованием глутамата:
Таким образом, большинство аминогрупп различных аминокислот оказывается в составе глутамата, который легко подвергается дезаминированию.
Реакции дезаминирования аминокислот приводят к освобождению NH 2 -группы в виде аммиака и осуществляются тремя разными путями. Различают окислительное, гидролитическое и прямое дезаминирование (рис. 16.12). Наиболее распространенным типом является окислительное дезаминирование , которое осуществляется по a-аминогруппе и катализируется в основном глутаматдегидрогеназой - типичным для печени ферментом. Необычным свойством этого фермента является способность использовать как NAD, так и NADP в качестве коферментов. Активность глутаматдегидрогеназы регулируется аллостерическими активаторами (ADP, GDP) и ингибиторами (ATP, GTP).
Окислительное дезаминирование осуществляется в две стадии с образованием иминокислоты в качестве промежуточного продукта, который спонтанно гидролизуется, превращаясь в кетокислоту и аммиак (рис. 16.12). Обе реакции обратимы, и их константы равновесия близки к единице. Ранее (рис. 16.3) было показано, как в ходе обратной реакции аммиак включается в состав глутамата. Можно считать, что реакция образования и дезаминирования глутамата является центральной реакцией в процессе метаболизма аммиака.
У многих организмов окислительное дезаминирование осуществляется с помощью дегидрогеназ, использующих флавиновые кофакторы (FMN, FAD). Эти ферменты называют оксидазами аминокислот. Они характеризуются широкой субстратной специфичностью: одни специфичны к L-аминокислотам, другие - к их D-аналогам. Считается, что эти ферменты вносят небольшой вклад в обмен аминогрупп.
Гидролитическому дезаминированию подвержены немногие аминокислоты, из протеиногенных - аспарагин и глутамин. При их дезаминировании образуются соответственно аспартат и глутамат. Этот процесс правильнее называть дезамидированием, поскольку он осуществляется за счет амидной группы (рис. 16.12). В редких случаях таким путем отщепляется и aаминогруппа аминокислоты, тогда образуются аммиак и оксикислота.
В результате прямого (внутримолекулярного) дезаминирования возникают ненасыщенные соединения. Прямому дезаминированию обычно подвергается гистидин, а также серин. Однако первичная ферментативная атака серина приводит к отщеплению молекулы воды (фермент-серингидратаза), и в этом превращении участвует боковая гидроксильная группа серина. Спонтанному дезаминированию в данном случае подвергается нестабильное промежуточное соединение - аминоакрилат. Продуктом суммарной реакции является пируват, и этот тип дезаминирования вызывается перестройкой в боковой цепи аминокислоты.
Реакции аминокислот по карбоксильной группе . Превращения по карбоксильной группе аминокислот могут использоваться организмами для деградации этих молекул, а также для превращения в другие, необходимые клетке соединения, в первую очередь аминоациладенилаты и биогенные амины. Образование аминоациладенилатов на подготовительной стадии синтеза белка уже было описано в главе 3. Биогенные амины возникают в реакциях, катализируемых декарбоксилазами аминокислот. Эти ферменты широко распространены у животных, растений и особенно у микроорганизмов, причем известно, что у патогенных микроорганизмов декарбоксилазы могут служить факторами агрессии , с помощью которых возбудитель проникает в соответствующие ткани. Декарбоксилазы L-аминокислот, так же как трансаминазы, используют в качестве простетической группы пиридоксальфосфат.
Моноамины (биогенные амины) выполняют в организмах разнообразные функции. Например, этаноламин, образующийся при декарбоксилировании серина, является составной частью полярных липидов. При декарбоксилировании цистеина и аспартата образуются соответственно цистеамин и b-аланин, которые входят в состав такого важного для клеток кофермента, как коэнзим А. Декарбоксилирование гистидина приводит к образованию гистамина - медиатора, участвующего в регуляции скорости метаболических процессов, деятельности желез внутренней секреции, регуляции кровяного давления у животных. Многие другие биогенные амины выполняют функции сигнальных веществ, в частности широко распространенных у животных и человека нейромедиаторов.
Реакции аминокислот по боковой цепи . Насколько разнообразна структура радикалов аминокислот, настолько разнообразны и химические превращения, которым они могут подвергаться. Среди этих многообразных реакций можно выделить те, которые позволяют клетке получать из одних аминокислот другие. Например, тирозин образуется при окислении ароматического кольца фенилаланина; гидролиз аргинина приводит к формированию орнитина (см. цикл мочевины); расщепление треонина сопровождается образованием глицина и т. п.
Кроме этих реакций, важное значение имеют превращения боковых групп, связанные с возникновением физиологически активных веществ. Так, из тирозина образуется гормон адреналин, из триптофана образуются никотиновая кислота (витамин РР, входящий в состав никотинамидных коферментов) и индолилуксусная кислота (ростовое вещество), из цистеина-меркаптуровые кислоты (участвуют в обезвреживании ароматических соединений). Уже отмечалась возможность превращения серина в пируват при дегидратации его боковой цепи и дезаминировании.
Таким образом, разнообразные химические превращения аминокислот могут приводить к образованию биологически активных веществ с широким спектром действия и, кроме того, к отщеплению аминогрупп в виде аммиака с формированием углеродных скелетов. В следующем разделе будет рассмотрена судьба аммиака и углеродных атомов расщепленных аминокислот.
У человека основным способом дезаминирования является окислительное дезаминирование . Выделяют два варианта окислительного дезаминирования: прямое и непрямое .
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH 3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное ) и не нуждаться в кислороде (анаэробное ).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы ) в качестве кофермента использующими ФАД , и оксидазами L-аминокислот (L-оксидазы ) с коферментом ФМН . В организме человека эти ферменты присутствуют, но практически неактивны.
Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой , превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с аминокислот и формирует с ним процесс трансдезаминирования (см ниже).

Реакция прямого окислительного дезаминирования
глутаминовой кислоты
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH 2 -группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз . Этот перенос называется и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота , которая превращается в глутамат ("аминокислота 2").

Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH 2 -группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО 2 и Н 2 О.
При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться в печени для синтеза глюкозы в глюконеогенезе . В этом случае количество аминотрансфераз в гепатоците увеличивается под влиянием глюкокортикоидов .
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование .
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота , то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой , которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование .

Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины , которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза .
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН .
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования :
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для
Аминокислоты - гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу - NH 2 и карбоксильную группу -СООН, связанные с углеводородным радикалом.Общую формулу простейших аминокислот можно записать так:
![]()
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа - NH 2 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа -СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты - это амфотерные органические соединения. Со щелочами они реагируют как кислоты:
С сильными кислотами- как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:

Ионизация молекул аминокислот зависит от кислотного или щелочного характера среды:

Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R- они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым , т. к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин. Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки -NH-СО-, например:


Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полимамидов.
К ним, кроме названного выше синтетического волокна капрона, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды альфа-аминокислот называются пептидами . В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды . В таких соединениях группы -NH-СО- называют пептидными.
Большую часть метаболической энергии, вырабатываемой в тканях, поставляют процессы окисления углеводов и триацилглицеролов; у взрослого мужчины до 90% всей потребности в энергии покрывается из этих двух источников. Остальную энергию (в зависимости от рациона от 10 до 15%) дает окисление аминокислот.
Хотя роль аминокислот в организме определяется в первую очередь тем, что они служат строительными блоками для биосинтеза белков, в известных условиях они могут претерпевать и окислительное расщепление. Это возможно в трех случаях. 1) Если аминокислоты, высвобождающиеся при обычном динамическом обновлении белков, не используются для синтеза новых белков, то они подвергаются окислительному расщеплению. 2) Если организм получает с пищей больше аминокислот, чем это ему необходимо для белкового синтеза, то избыточное их количество расщепляется, потому что аминокислоты не откладываются в организме в запас. 3) Во время голодания или при сахарном диабете, т.е. тогда, когда углеводов нет или когда их утилизация нарушена, в качестве топлива используются белки. Во всех этих ситуациях аминокислоты теряют свои аминогруппы и превращаются в соответствующие -кетокислоты, которые затем окисляются до и воды; частично это окисление идет через цикл лимонной кислоты.
В этой главе мы познакомимся с метаболическими путями, по которым идет окислительное расщепление двадцати обычных аминокислот, входящих в состав белков. Мы узнаем также, что у разных видов животных отщепляемый от аминокислот аммиак выводится из организма в различной химической форме.
19.1. Перенос а-аминогрупп катализируется трансаминазами
Аминогруппы двадцати обычных -аминокислот, обнаруживаемых в белках, отщепляются на одной из стадий окислительного расщепления аминокислот. Если эти аминогруппы не используются повторно для синтеза новых аминокислот или других азотсодержащих соединений, то они собираются в одной форме, превращаются в конце концов в один общий конечный продукт и в таком виде выводятся из организма. У человека и у большинства других наземных позвоночных таким конечным продуктом является мочевина. Отщепление -аминогрупп от большей части L-аминокислот катализируется ферментами, которые называются трансаминазами или аминотрансферазами. В таких ферментативных реакциях трансаминирования -аминогруппа переносится от аминокислоты на -углеродный атом -кетоглутарата, в результате чего образуется -кетоаналог исходной аминокислоты и -глутамат, представляющий собой продукт аминирования -кетоглутарата (рис. 19-1).

Рис. 19-1. Реакция трансаминирования. Переносимая аминогруппа выделена красным. В большей части реакций трансаминирования акцептором аминогрупп служит -кетоглутарат.
Отметим, что реального дезаминирования, т.е. потери аминогрупп, в таких реакциях не происходит, поскольку дезаминирование -аминокислоты сопровождается аминированием -кетоглутарата. Смысл трансаминирования состоит в его коллекторной функции, иными словами, в том, что аминогруппы от многих разных аминокислот собираются в одной форме в виде -глутаминовой кислоты. Таким образом, катаболизм различных аминокислот приводит в конечном итоге к одному единственному продукту.
Большинство трансаминаз проявляет специфичность в отношении акцептора аминогрупп: таким акцептором в приведенной выше реакции служит для них -кетоглутарат. Менее специфичны трансаминазы в отношении другого субстрата, т.е. той аминокислоты, которая играет роль донора аминогрупп. Ниже приведено несколько реакций, в которых участвуют наиболее важные трансаминазы (в названии ферментов указывается аминокислота, играющая роль донора аминогрупп):

Итак, общим акцептором, принимающим аминогруппу от большинства аминокислот, является -кетоглутарат. Образовавшийся -глутамат служит для того, чтобы направлять аминогруппы на определенные биосинтетические пути (гл. 22) и в ту конечную последовательность реакций, посредством которой образуются продукты азотистого обмена, выводимые затем из организма. Реакции, катализируемые трансаминазами, легко обратимы, поскольку их константы равновесия близки к 1,0. Это означает, что величина для таких реакций близка к нулю (разд. 14.3).
У всех трансаминаз имеется прочно связанная простетическая группа, и механизм их действия одинаков. Простетической группой трансаминаз служит пиридоксальфосфат - производное пиридоксина, или витамина (разд. 10.8). Пиридоксальфосфат действует как промежуточный переносчик аминогрупп в активном центре трансаминаз (рис. 19-2).

Рис. 19-2. Простетическая группа трансаминаз. Пиродоксальфосфат и его аминированная форма - пиридоксаминфосфат (Б) - это прочно связанные коферменты трансаминаз. Функциональные группы, от которых зависит их действие, показаны на красном фоне. В. Пиридоксальфосфат играет роль промежуточного переносчика аминогрупп при действии трансаминаз. Е означает здесь ферментный белок, а - прочно связанный пиридоксальфосфат. Трансаминазы катализируют бимолекулярные реакции, протекающие по механизму типа «пинг-понг». Первый субстрат - отдав свою аминогруппу, покидает фермент в виде -кетокислоты до того, как к ферменту присоединится второй
Во время каталитического цикла он претерпевает обратимые переходы между альдегидной формой (пиридоксальфосфат), способной присоединять аминогруппы, и аминированной формой (пиридоксаминфосфат), способной передавать аминогруппы на -кетоглутарат. Таким образом, эта простетическая группа действует как обратимый переносчик аминогрупп от -аминокислоты на -кетоглутарат (рис. 19-2). Трансаминазы - классический пример ферментов, катализирующих бимолекулярные реакции, протекающие по механизму типа «пинг-понг» (разд. 9.8). В таких реакциях первый субстрат должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться. Сначала с активным центром фермента связывается приходящая аминокислота, которая отдает свою аминогруппу пиридоксальфосфату и в форме -кетокислоты покидает активный центр. Затем с активным центром связывается приходящая -кетокислота; она принимает аминогруппу от пиридоксаминфосфата и отделяется от активного центра, теперь уже в форме аминокислоты.
На рис. 19-3 видно, что карбонильная группа связанного с ферментом пиридоксальфосфата взаимодействует с -амино-группой приходящей аминокислоты, в результате чего образуется промежуточный продукт, представляющий собой ковалентное соединение - шиффово основание.

Рис. 19-3. Схема, поясняющая действие пиридоксальфосфата в трансаминазах. Аминогруппа приходящей -аминокислоты (А) взаимодействует с карбонильной группой пиридоксальфосфата, прочно связанного с ферментом. При этом в качестве промежуточного продукта образуется шиффово основание (Б), которое переходит затем в свою таутомерную форму (В). Последняя гидролизуется с образованием соответствующей -кетокислоты, которая удаляется, в то время как аминогруппа остается ковалентно связанной с трансаминазой в форме пиридоксаминфосфата (Г). Поскольку эти реакции обратимы, аминированная форма трансаминазы передает затем свою аминогруппу на приходящую в результате чего образуется новая аминокислота.
Затем происходит сдвиг двойной связи и гидролитическое отщепление углеродного скелета аминокислоты; при этом ее аминогруппа остается ковалентно связанной с простетической группой в форме пиридоксаминфосфата. Пиридоксаминфосфат образует теперь шиффово основание с приходящим -кетоглутаратом, на который и переносится аминогруппа; перенос совершается, по сути, путем обращения тех реакций, в которых образовался пиридоксаминфосфат.
В медицине определение аланин-трансаминазы и аспартат-трансаминазы в сыворотке крови служит важным методом диагностики и оценки результатов лечения при инфаркте миокарда. Этот же метод используется и для обнаружения токсического действия некоторых химических реактивов (дополнение 19-1).