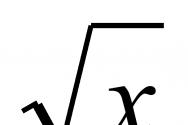Факторы агрегативной устойчивости коллоидных систем. Виды коагуляции коллоидных систем. Устойчивость коллоидных растворов Защитное действие молекулярных
Как указывалось в § 106, качественная особенность дисперсных систем состоит в их агрегативной неустойчивости.
Предотвращение агрегации первичных дисперсных частиц возможно в результате действия трех факторов устойчивости дисперсных систем: 1) кинетического; 2) электрического и 3) структурно-механического.
Необходимым условием слипания двух частиц дисперсной фазы является их сближение, достаточное для проявления сил притяжения. Если частота столкновений коллоидных частиц мала, то дисперсная система может быть устойчивой (кинетический фактор устойчивости). Это может иметь место при очень малой концентрации дисперсных частиц (например, в некоторых аэрозолях) или при очень большой вязкости дисперсионной среды (например, в дисперсных системах типа T 1 -T 2).
Большинство устойчивых дисперсных систем кроме дисперсной фазы и дисперсионной среды содержат еще третий компонент, являющийся стабилизатором дисперсности. Стабилизатором могут быть как ионы, так и молекулы, в связи с чем различают два механизма стабилизации дисперсных систем: электрический и молекулярноадсорбционный.
Электрическая стабилизация дисперсных систем связана с возникновением двойного электрического слоя на границе раздела фаз. Такая стабилизация имеет основное значение для получения устойчивых лиозолей и суспензий в полярной среде, например в воде. В любом гидролизе все коллоидные частицы имеют одинаковый знак заряда. Однако коллоидная мицелла в целом электронейтральна в результате образования двойного электрического слоя. Поэтому электростатическое отталкивание между коллоидными частицами (.электрический фактор устойчивости) возникает только при достаточном их сближении, когда происходит перекрывание их ионных атмосфер (рис. 102). Потенциальная энергия электростатического отталкивания тем больше, чем больше перекрывание диффузных частей двойного электрического слоя коллоидных частиц, т.е. чем меньше расстояние (х) между ними и чем больше толщина двойного электрического слоя.
Рис. 102.
Кроме электростатического отталкивания между коллоидными частицами, как и между молекулами любого вещества, действуют межмолекулярные силы притяжения, среди которых наибольшую роль играют дисперсионные силы. Действующие между отдельными молекулами дисперсионные силы быстро убывают с увеличением расстояния между ними. Но взаимодействие коллоидных частиц обусловлено суммированием дисперсионных сил притяжения между всеми молекулами, находящимися на поверхности контакта коллоидных частиц. Поэтому силы притяжения между коллоидными частицами убывают медленнее и проявляются на больших расстояниях, чем в случае отдельных молекул.
Потенциальная энергия взаимодействия (U) между коллоидными частицами представляет собой алгебраическую сумму потенциальной энергии электростатического отталкивания (U 3) и потенциальной энергии дисперсионного притяжения (U a) между ними:
![]()
Если U 3 > U a (по абсолютной величине), то отталкивание преобладает над притяжением и дисперсная система устойчива. Если U 3 то происходит слипание сталкивающихся при броуновском движении коллоидных частиц в более крупные агрегаты и седиментация последних. Коллоидный раствор коагулирует, т.е. разделяется на коагулят (осадок) и дисперсионную среду.
В этом состоит сущность теории электрической стабилизации и коагуляции дисперсных систем, развитой впервые Б.В. Дерягиным (1937 г.), а затем Л.Д. Ландау и голландскими учеными Фервеем и Овербеком (1948 г.); по первым буквам фамилий авторов ее называют теорией ДЛФО.

Рис. 103.
1 - электрическое отталкивание (U 3); 2 - дисперсионное притяжение (1/ д): 3 - результирующая энергия взаимодействия (JJ)] 4 - то же, но при более крутом падении кривой 1] х - расстояние между частицами; U m3kc - потенциальный барьер взаимодействия дисперсных частиц
На рис. 103 приведены зависимости величин U a и U 3 от расстояния между коллоидными частицами. При этом, как принято в физике, потенциальной энергии притяжения приписывается знак минус, а отталкивания - знак плюс. Как видно, результирующая энергия взаимодействия (кривая 3 на рис. 103) приводит к притяжению (U (JJ > 0) на больших расстояниях между частицами. Решающее значение для устойчивости дисперсных систем имеет величина потенциального барьера отталкивания (U m3kc), которая, в свою очередь, зависит от хода кривых U a и U 3 . При больших значениях этого барьера коллоидная система устойчива. Слипание коллоидных частиц возможно лишь при достаточном их сближении. Это требует преодоления потенциального барьера отталкивания. При некоторых небольших положительных значениях U m3kc (кривая 3) преодолеть его могут лишь немногие коллоидные частицы с достаточно большой кинетической энергией. Это соответствует стадии медленной коагуляции, когда только небольшая часть соударений коллоидных частиц приводит к их слипанию. При медленной коагуляции со временем происходит некоторое уменьшение общего числа коллоидных частиц в результате образования агрегатов из 2-3 первичных частиц, но коагулят не выпадает. Подобную коагуляцию, не сопровождающуюся видимым изменением коллоидного раствора, называют скрытой коагуляцией. При дальнейшем уменьшении потенциального барьера скорость коагуляции, характеризуемая изменением числа частиц в единицу времени, возрастает. Наконец, если потенциальный барьер переходит из области отталкивания в область притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция , когда каждое соударение коллоидных частиц приводит к их слипанию; в коллоидном растворе образуется осадок - коагулят, происходит явная коагуляция.
Потенциальный барьер отталкивания (U m1ikc) возникает в результате суммирования сил отталкивания и притяжения, действующих между коллоидными частицами. Поэтому все факторы, влияющие на ход кривых 1 и 2 (рис. 103), приводят к изменению как величины U mskc , так и положения максимума (т.е. расстояния х, соответствующего?/ макс).
Значительное уменьшение U mskc происходит в результате изменения потенциальной энергии электростатического отталкивания (т. е. хода кривой 1), вызванного добавлением электролитов к коллоидному раствору. C увеличением концентрации любого электролита происходит перестройка двойного электрического слоя, окружающего коллоидные частицы: все большая часть противоионов вытесняется из диффузной в адсорбционную часть двойного электрического слоя. Толщина диффузной части двойного электрического слоя (слой 4 на рис. 100), а вместе с ней и всего двойного электрического слоя (слой 2 на рис. 100) уменьшается. Поэтому кривая потенциальной энергии электростатического отталкивания снижается более круто, чем показанная на рис. 103 кривая 1. В результате этого потенциальный барьер отталкивания (U mskc) уменьшается и смещается в сторону меньшего расстояния между коллоидными частицами. Когда двойной электрический слой сжимается до толщины адсорбционного слоя (слой 3 на рис. 100), то вся кривая взаимодействия дисперсных частиц оказывается в области притяжения (кривая 4 на рис. 103), наступает быстрая коагуляция. Такое изменение устойчивости коллоидного раствора происходит при добавлении любого электролита.
Коагулирующее действие электролитов характеризуют порогом коагуляции, т.е. наименьшей концентрацией электролита, вызывающей коагуляцию. В зависимости от природы электролита и коллоидного раствора порог коагуляции изменяется в пределах от IO -5 до 0,1 моль в литре золя. Наиболее существенное влияние на порог коагуляции оказывает заряд коагулирующего иона электролита, т.е. иона, заряд которого противоположен по знаку заряду коллоидной частицы.
Многозарядные противоионы электролита имеют повышенную адсорбционную способность по сравнению с однозарядными и проникают в адсорбционную часть двойного электрического слоя в больших количествах. При этом порог коагуляции уменьшается не пропорционально заряду противоиона, а значительно быстрее.
Блестящим подтверждением теории ДЛФО явился расчет Б.В. Дерягиным и Л.Д. Ландау (1941 г.) соотношения значений порогов коагуляции вызываемой электролитами, содержащими ионы с разной величиной заряда. Оказалось, что порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона. Следовательно, значения порогов коагуляции для одно-, двух-, трех- и четырехзарядных ионов должны относиться, как
что близко к соотношениям концентраций электролитов, которые наблюдались при коагуляции разнообразных гидрозолей. Сказанное иллюстрируют данные табл. 22, где приведены эквивалентные концентрации электролитов (С к), вызывающие коагуляцию гидрозоля оксида мышьяка (III).
Таблица 22
Пороги коагуляции (C k отрицательно заряженного золя As 2 O 3 электролитами)
|
Электролит |
C k -IO 3 , н. |
Электролит |
C k -IO 3 , и. |
||
|
(C k)uci |
|||||
Молекулярно-адсорбционная стабилизация дисперсных систем играет большую роль в устойчивости дисперсий как в водной, так и в неводных средах. Дисперсные системы в неводных средах, в принципе, менее устойчивы, чем в водной среде. В неполярной и не содержащей воды дисперсионной среде частицы дисперсной фазы лишены электрического заряда. Электрический фактор стабилизации отсутствует. Между дисперсными частицами действуют только силы взаимного притяжения. Ослабление этих сил, приводящее к стабилизации дисперсных систем, может происходить в результате образования вокруг коллоидных частиц адсорбционных слоев из молекул дисперсионной среды и растворенных в ней веществ. Такие слои ослабляют взаимное притяжение частиц дисперсной фазы и создают механическое препятствие их сближению.
Стабилизация дисперсных систем за счет сольватации дисперсной фазы молекулами дисперсионной среды возможна как в полярных, так и в неполярных средах. Так, гидратация частиц глины и кремниевой кислоты имеет существенное значение для устойчивости суспензий глин и золя кремниевой кислоты в водной среде.
Однако стабилизация дисперсных систем значительно более эффективна при добавлении к ним поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений, адсорбирующихся на границе раздела фаз. Адсорбционные слои ПАВ и высокомолекулярных соединений, обладая упругостью и механической прочностью, предотвращают слипание дисперсных частиц. Образование таких молекулярно-адсорбционных твердообразных поверхностных слоев П.А. Ребиндер назвал структурно-механическим фактором стабилизации дисперсных систем. Этот механизм стабилизации играет основную роль при получении предельно устойчивых высококонцентрированных пен, эмульсий, коллоидных растворов и суспензий не только в неводных, но и в водных средах. Для структурно-механической стабилизации дисперсий в водной среде применяют мыла щелочных металлов, белки, крахмал, а в неводных средах - мыла щелочноземельных металлов, смолы, каучуки. Такие вещества называют защитными коллоидами.
- Борис Владимирович Дерягин (1902-1994) - академик, автор современной теории устойчивости и коагуляции коллоидов, электрической теории склеивания и прилипания, важных исследований в области аэрозолей.
- Петр Александрович Ребиндер (1898-1972) - советский физик-химик, академик, лауреат Государственных премий, основатель крупной научной школы в областифизической химии дисперсных систем. Разработанные им пути управления свойствамидисперсных систем, процессами их образования и разрушения тесно связаны с решением крупных технических задач.
Основным методом очистки природных и сточных вод от мелкодисперсных, эмульгированных, коллоидных и окрашенных примесей (1 и 2 группы) является коагуляция и флокуляция. Методы основаны на агрегировании частиц дисперсной фазы с последующим их удалением из воды механическим отстаиванием.
Эффективность и экономичность процессов коагуляционной очистки сточных вод определяется устойчивостью дисперсной системы, которая зависит от ряда факторов: степени дисперсности, характера поверхности частиц, плотности частиц, величины электрокинетического потенциала, концентрации, наличия в сточной воде других примесей, например, электролитов, высокомолекулярных соединений.
Существуют различные способы проведения коагуляции, целесообразность применения которых зависит от факторов обусловливающих агрегативную устойчивость систем.
Агрегативная устойчивость коллоидных систем зависит от их строения.
Обладая большой удельной поверхностью, коллоидные частицы способны адсорбировать из воды ионы, вследствие чего соприкасающиеся фазы приобретают заряды противоположного знака, но равные по величине. В результате на поверхности возникает двойной электрический слой. Ионы относительно прочно связанные с дисперсной твердой фазой называют потенциалопределяющими . Они нейтрализуются избытком противоионов . Толщина двойного слоя в водных растворах не превышает 0,002 мм.
Степень адсорбции ионов зависит от сродства адсорбируемых ионов к поверхности, их способности образовывать недиссоциируемые поверхностные соединения. При адсорбции ионов одинаковой валентности адсорбционная способность повышается с увеличением радиуса иона и, соответственно, его поляризуемости, т.е. способности притягиваться к поверхности коллоидной частицы. Увеличение радиуса иона сопровождается также уменьшением его гидратации, наличие плотной гидратной оболочки препятствует адсорбции, т.к. уменьшает электрическое взаимодействие иона с поверхностью коллоидной частицы.
Согласно современным представлениям о строении двойного электрического слоя слой противоинов состоит из двух частей. Одна часть примыкает к межфазной поверхности и образует адсорбционный слой, толщина которого равна радиусу составляющих его гидратированных ионов. Другая часть противоионов находится в диффузном слое, толщина которого зависит от свойств и состава системы. В целом мицелла электронейтральна. Строение мицеллы – коллоидной частицы – представлено на рис.1.1.
Разность потенциалов между потенциалопределяющими ионами и всеми противоионами называется термодинамическим φ-потенциалом.
Заряд на частицах препятствует их сближению, чем, в частности, и определяется устойчивость коллоидной системы. В целом устойчивость коллоидных систем обусловлена наличием заряда у гранулы, диффузионного слоя и гидратной оболочки.
Рис.3.1. Строение мицеллы: Рис.3.2. Схема двойного электрического
I – ядро мицеллы; слоя в электрическом поле
II – адсорбционный слой; (I-II – гранула);
III – диффузионный слой;
IV – гидратная оболочка
При движении частицы в дисперсной системе или при наложении электрического поля часть противоионов диффузного слоя остается в дисперсной среде и гранула приобретает заряд, соответствующий заряду потенциалопределяющих ионов. Таким образом, дисперсионная среда и дисперсная фаза оказываются противоположно заряженными.
Разность потенциалов между адсорбционным и диффузным слоями противоионов называется электрокинетическимζ – потенциалом (рис. 1.2).
Электрокинетический потенциал является одним из важнейших параметров двойного электрического слоя. Величина ζ – потенциала обычно составляет единицы и десятки милливольт в зависимости от состава фаз и концентрации электролита. Чем больше величина ζ– потенциала, тем более устойчива частица.
Рассмотрим термодинамические и кинетические факторы устойчивости дисперсных систем:
· Электростатический фактор устойчивости . С позиции физической кинетики молекулярное притяжение частиц является основной причиной коагуляции системы (ее агрегативной неустойчивости). Если на коллоидных частицах образовался адсорбционный слой, имеющий ионную природу, то при достаточном сближении одноименно заряженных частиц возникают электростатические силы отталкивания. Чем толще двойной электрический слой, тем интенсивнее результирующая сила отталкивание частиц, тем больше высота энергетического барьера и тем меньше вероятность слипания частиц. Таким образом, устойчивость коллоидных систем в присутствии ионного стабилизатора зависит от свойств двойного электрического слоя.
· Сольватационный фактор устойчивости . Силы отталкивания могут быть вызваны существованием на поверхности сближающихся частиц сольватных (гидратных) оболочек или так называемых граничных фаз, состоящих лишь из молекул дисперсионной среды и обладающих особыми физическими свойствами. Ядро мицеллы нерастворимо в воде, следовательно, и не гидратировано. Ионы, адсорбированные на поверхности ядра, и противоионы двойного электрического слоя гидратированы. Благодаря этому вокруг ядра создается ионно-гидратная оболочка. Толщина ее зависит от распределения двойного электрического слоя: чем больше ионов находится в диффузном слое, тем больше и толщина гидратной оболочки.
· Энтропийный фактор устойчивости. Обусловлен тепловым движением сегментов молекул ПАВ, адсорбированных на коллоидных частицах. При сближении частиц, имеющих адсорбционные слои из молекул ПАВ или высокомолекулярных веществ, происходит сильное уменьшение энтропии адсорбционного слоя, что препятствует агрегированию частиц.
· Структурно-механический фактор устойчивости. Адсорбционно-сольватные слои ПАВ могут представлять собой структурно-механический барьер, препятствующий сближению частиц. Защитные слои противоионов-стабилизаторов, являясь гелеобразными, обладают повышенной структурной вязкостью и механической прочностью.
· Гидродинамический фактор устойчивости . Скорость коагуляции может снижаться благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
· Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно. Особенно высокая устойчивость наблюдается при совокупности действия термодинамических и кинетических факторов, когда наряду со снижением межфазного натяжения проявляются структурно-механические свойства межчастичных прослоек.
Необходимо иметь в виду, что каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, действие электростатического фактора значительно снижается при введении в систему электролитов, которые сжимают двойной электрический слой.
Сольватация при сольватационном факторе может быть исключена лиофобизацией частиц дисперсной фазы с помощью адсорбции соответствующих веществ. Действие структурно-механического фактора можно снизить с помощью веществ, разжижающих и растворяющих упругие структурированные слои на поверхности частиц.
Дестабилизация системы может быть вызвана различными причинами, результатом многих из них является сжатие диффузного слоя, а следовательно, и уменьшение значения ζ-потенциала. Сжатие диффузного слоя уменьшает и степень гидратации ионов, в изоэлектрическом состоянии (ζ= 0, мВ) гидратная оболочка вокруг ядра предельно тонка (10 -10 м) и не защищает мицеллы от слипания при столкновении, в результате начинается агрегация частиц.
Седиментационная устойчивость коллоидных систем (СУ) – способность дисперсной системы сохранять равномерное распределение частиц по всему объему) обусловлена броуновским движением коллоидных дисперсий и диффузией частиц дисперсной фазы.
Седиментационная устойчивость системы зависит от действия двух факторов, направленных взаимно противоположно: силы тяжести, под действием которой частицы оседают, и диффузии, при которой частицы стремятся к равномерному распределению по объему. В результате возникает равновесное диффузионно-седиментационное распределение частиц по высоте, зависящее от их размера.
Диффузия замедляется с увеличением размера частиц. При достаточно высокой степени дисперсности частиц броуновское движение, как движение диффузионное, приводит к выравниванию концентраций по всему объему. Чем меньше частицы, тем больший срок требуется для установления равновесия.
Скорость оседания частиц пропорциональна квадрату их диаметра. В грубодисперсных системах скорость достижения равновесия сравнительно большая и равновесие устанавливается в течение нескольких минут или часов. В тонкодисперсных растворах она мала, и до момента равновесия проходят годы или даже десятки лет.
Виды коагуляции
В современной теории коагуляции дисперсных систем разработанной Дерягиным, Ландау, Фервеем, Овербеком (теория ДЛФО) степень устойчивости системы определяется из баланса молекулярных и электростатических сил. Различают два типа коагуляции:
1) концентрационную, при которой потеря устойчивости частиц связана со сжатием двойного слоя;
2) нейтрализационную (коагуляция электролитами), когда наряду со сжатием двойного слоя уменьшается потенциал φ 1 .
Концентрационная коагуляция характерна для сильно заряженных частиц в высококонцентрированных растворах электролитов. Чем выше потенциала φ 1 ДЭС, тем сильнее противоионы притягиваются к поверхности частиц и своим присутствием экранируют рост электрического поля. Поэтому при высоких значениях φ 1 силы электростатического отталкивания между частицами не возрастают безгранично, а стремятся к некоторому конечному пределу. Этот предел достигается при φ 1 более 250 мв. Отсюда следует, что взаимодействие частиц с высоким φ 1 -потенциалом не зависит от величины этого потенциала, а определяется только концентрацией и зарядом противоионов.
По мере увеличения концентрации электролита величина ζ – потенциала (ДП) снижается, а φ 1 практически сохраняет свое значение (рис. 3.3).
Под устойчивостью дисперсных систем понимают неизменность их свойств и состава во времени, в том числе дисперсности фазы, межчастичного взаимодействия. Здесь рассматриваются вопросы устойчивости систем по отношению к укрупнению или агрегации частиц дисперсной фазы, к их осаждению. Ликвидация агрегативной устойчивости необходима в процессах выделения осадков при разделении фаз, при очистке сточных вод и промышленных выбросов.
По классификации П.А. Ребиндера дисперсные системы делят на лиофильные, получающиеся при самопроизвольном диспергировании одной из фаз, и лиофобные, получающиеся при принудительном диспергировании и конденсации с пересыщением. Лиофобные системы обладают избытком поверхностной энергии, в них самопроизвольно могут идти процессы укрупнения частиц, т.е. может происходить снижение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы и называют агрегативно неустойчивыми.
Агрегация частиц может заключаться в переносе вещества от мелких частиц к крупным, так как химический потенциал последних меньше /изотермическая перегонка/. Крупные частицы растут, а мелкие частицы постепенно растворяются /испаряются/. Агрегация частиц может происходить и путем слипания /слияния/ частиц – наиболее характерный путь для дисперсных систем /коагуляция/.
Различают термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем. Движущей силой коагуляции является избыточная поверхностная энергия. Основными факторами, влияющими на устойчивость систем, являются факторы, снижающие поверхностное натяжение при сохранении размера поверхности. Эти факторы относят к термодинамическим. Они уменьшают вероятность эффективных соударений частиц, создают потенциальные барьеры, замедляющие или даже исключающие процесс коагуляции. Чем меньше поверхностное натяжение, тем больше термодинамическая устойчивость системы.
Кинетические факторы связаны в основном с гидродинамическими свойствами среды: замедление сближения частиц, разрушение прослоек среды между частицами. В целом, различают следующие факторы устойчивости дисперсных систем:
1. Гидродинамический – из-за изменения вязкости среды и плотности фазы и дисперсионной среды снижается скорость коагуляции;
2. Структурно – механический фактор обусловлен наличием на поверхности частиц упругой, механически прочной пленки, разрушение которой требует затрат энергии и времени;
3. Электростатический – из-за возникновения двойного электростатического слоя/ДЭС/ на поверхности частиц уменьшается межфазное натяжение. Появление электрического потенциала на межфазной поверхности возможно из-за поверхностной электролитической диссоциации или адсорбции электролитов;
4. Энтропийный фактор проявляется в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении. Сущность его состоит в стремлении дисперсной фазы к равномерному распределению по объему системы;
5. Адсорбционно-сольватный – проявляется в уменьшении межфазного натяжения вследствие адсорбции и сольватации при взаимодействии частиц с дисперсионной средой.
В реальных системах агрегативная устойчивость определяется одновременно совокупностью термодинамических и кинетических факторов.
Согласно современным представлениям устойчивость систем (лиофобных коллоидов) определяется балансом сил молекулярного притяжения и электростатического отталкивания между частицами. Универсальным свойством дисперсных систем является наличие на границе раздела фаз двойного электрического слоя (ДЭС).
Поверхностный заряд частиц образуется в результате одного из процессов:
– диссоциации поверхностных групп частиц;
– адсорбции потенциалопределяющих ионов, т.е. ионов, входя щих в состав кристаллической решетки или сходных с ними;
– адсорбции ионогенных ПАВ;
– изоморфного замещения, например, заряд частиц большинства глин формируется за счет замещения четырехвалентных ионов кремния на Аl +3 или Са +2 , с дефицитом положительного заряда на частице.
В первых трех случаях поверхностный заряд можно контролировать, в определенных пределах регулировать величину заряда, знак, изменяя концентрацию ионов в системе. Например, в результате диссоциации поверхностных силанольных групп частицы кремнезема могут приобретать заряд:
Плотность поверхностного заряда равна числу элементарных зарядов на единице поверхности. Поверхностный заряд частицы в дисперсной системе компенсируется суммой зарядов, локализованных в диффузной и плотной (непосредственно прилегающей части монослоя противоионов) частях ДЭС.
Явление возникновения разности потенциалов при осаждении дисперсной фазы получило название потенциала седиментации /оседания/. При относительном перемещении фаз независимо от причин, вызывающих перемещение, происходит разрыв ДЭС по плотности скольжения. Плоскость скольжения обычно проходит по диффузному слою ДЭС, и часть его ионов остается в дисперсионной среде. В результате дисперсионная среда и ее дисперсная фаза оказываются противоположно заряженными. Потенциал, возникающий на плоскости скольжения при отрыве части диффузного слоя, называется электрокинетическим потенциалом, или z /дзета/-потенциалом. Дзета-потенциал, отражая свойства ДЭС, характеризует природу фаз и межфазного взаимодействия. Величина электрокинетического потенциала зависит от скорости движения фаз, вязкости среды, природы фаз и других факторов. Понижение температуры, введение в систему электролитов, специфически взаимодействующих с поверхностью, увеличение заряда ионов электролита приводит к уменьшению дзета-потенциала.
Величина дзета-потенциала зависит от природы поверхности контактирующих фаз. На поверхностях полиэлектролитов, содержащих ионогенные группы, а так же на поверхности многих неорганических оксидов величина дзета-потенциала может достигать высоких значений - 100 мВ и более. Если на поверхности адсорбируются противоионы, то электрокинетический потенциал уменьшается. Значительное влияние оказывает величина рН среды, так как ионы Н + и ОН – обладают высокой адсорбционной способностью. Знак и значение дзета-потенциала широко используются для характеристики электрических свойств поверхностей при рассмотрении агрегативной устойчивости дисперсных систем.
В первом приближении принято считать, что устойчивость дисперсных систем определяется величиной электрокинетического z (дзета) потенциала. При добавлении к системам электролитов или ПАВ происходит изменение структуры ДЭС, изменение величины z – потенциала при неизменной величине поверхностного потенциала. Это изменение (уменьшение) наиболее значительно с ростом заряда противоиона при одинаковой концентрации электролита (рис.2.1).
Высокозарядные противоионы /Al +3 ,Fe +3 /, сложные органические ионы вследствие действия вандерваальсовых сил могут адсорбироваться сверхэквивалентно, т.е. в количествах, превышающих число зарядов на поверхности, накапливаясь в слое. В результате этого возможно изменение и величины, и знака электрокинетического потенциала. С такими явлениями часто встречаются при введении в дисперсные системы полиэлектролитов и коагулянтов.
В дисперсных системах при сближении одинаково заряженных частиц происходит их отталкивание, что не является чисто кулоновским, так как заряд поверхности полностью компенсирован зарядом противоионов. Силы отталкивания появляются при перекрывании диффузных ионных атмосфер. В тоже время между частицами действует вандерваальсово притяжение, состоящее из ориентационных, индукционных и дисперсионных сил. В определенных условиях эти силы соизмеримы с силами отталкивания. Полная энергия взаимодействия дисперсных частиц слагается из суммы энергий притяжения и отталкивания. Величина суммарной энергии частиц от расстояния между ними схематически показана на рис.2.2.
Рис.2.1. Зависимость величины z - потенциала от концентрации противоионов. На кривых указан заряд противоиона
Устойчивость дисперсных систем и коагуляция отражают непосредственно взаимодействие частиц дисперсной фазы между собой или с какими-либо макроповерхностями. В основе теории устойчивости лежит соотношение между силами притяжения и отталкивания частиц. Широкое признание получила теория устойчивости, впервые предложенная Б.В. Дерягиным и Л.Д. Ландау, учитывающая электростатическую составляющую расклинивающего давления (отталкивания) и его молекулярную составляющую (притяжение).
В упрощенном варианте общая энергия взаимодействия между двумя частицами, приходящаяся на единицу площади, равна
Е=Е пр +Е от. (2.1)
Рис.2.2. Зависимость энергии взаимодействия частиц (Е общ) от расстояния между ними (L ), Е общ =Е притяж +Е отталк
Каждую из этих составляющих можно выразить как функцию от расстояния между частицами
dЕ пр =Р пр dh, (2.2)
dE от =Р от dh, (2.3)
где Р пр – давление притяжения, т.е. молекулярная составляющая расклинивающего давления; Р от – давление отталкивания, в данном случае электростатическая составляющая расклинивающего давления.
Давление притяжения обусловлено обычно стремлением системы к уменьшению поверхностной энергии, его природа связана с ван-дер-ваальсовыми силами. Давление отталкивания обусловлено только электростатическими силами, поэтому
dР от = d , (2.4)
где - объемная плотность заряда в ЭДС, - электропотенциал двойного слоя.
Если частицы находятся на расстояниях, на которых взаимодействие не происходит, то ДЭС не перекрываются, и потенциалы в них практически равны нулю. При сближении частиц ДЭС перекрываются, в результате потенциалы значительно увеличиваются вплоть до 2 и силы отталкивания возрастают.
В области малых значений потенциалов электростатическая составляющая давления сильно зависит от значения потенциала, с ростом же потенциала эта зависимость становится менее заметной. Энергия отталкивания частиц возрастает с уменьшением расстояния h между ними по экспоненциальному закону.
Энергия притяжения частиц согласно упрощенному уравнению 2.5.обратно пропорциональна квадрату расстояния между ними.
Р пр = - , (2.5)
где n – число атомов в единице объема частицы; К – константа, зависящая от природы взаимодействующих фаз;
Энергия притяжения между частицами значительно медленнее уменьшается с расстоянием, чем энергия притяжения между молекулами (атомами). Отсюда следует, что частицы дисперсных систем взаимодействуют на более далеких расстояниях, чем молекулы.
Устойчивость дисперсных систем или скорость коагуляции зависит от знака и значения общей потенциальной энергии взаимодействия частиц. Положительная энергия отталкивания Е от с увеличением h уменьшается по экспоненциальному закону, а отрицательная Е пр обратно пропорциональна квадрату h. В результате на малых расстояниях (при h®0, Е от ®const, E пр ® ) и на больших расстояниях между частицами преобладает энергия притяжения, а на средних – энергия электростатического отталкивания.
Первичный минимум I (рис 2.2) отвечает непосредственному слипанию частиц, а вторичный минимум II – их притяжению через прослойку среды. Максимум, соответствующий средним расстояниям, характеризует потенциальный барьер, препятствующий слипанию частиц. Силы взаимодействия могут распространяться на расстояния до сотен нм, а максимальное значение энергии может превышать 10 -2 Дж/м 2 . Увеличению потенциального барьера способствует рост потенциала на поверхности частиц в области его малых значений. Уже при 20 мВ возникает потенциальный барьер, обеспечивающий агрегативную устойчивость дисперсных систем.
В различных отраслях промышленности встречаются дисперсные системы, содержащие разнородные частицы, отличающиеся химической природой, знаком и величиной поверхностного заряда, размерами. Агрегацию таких частиц (коагуляцию) называют гетерокоагуляцией. Это наиболее общий случай взаимодействия частиц при крашении, флотации, образовании донных отложений, осадков сточных вод. Термином взаимная коагуляция обозначают более частный случай – агрегацию разноименно заряженных частиц.
Процесс взаимной коагуляции широко используют на практике для разрушения агрегативной устойчивости дисперсных систем, например, при очистке сточных вод. Так, обработка сточных вод при определенных условиях солями алюминия или железа вызывает быструю коагуляцию взвешенных отрицательно заряженных веществ, взаимодействующих с положительно заряженными частицами гидроксидов алюминия и железа, образующимися при гидролизе солей.
Лиофильные коллоиды характеризуются интенсивным взаимодействием дисперсных частиц со средой и термодинамической устойчивостью системы. Решающая роль в стабилизации лиофильных коллоидов принадлежит сольватным слоям, формирующимся на поверхности дисперсной фазы в результате полимолекулярной адсорбции молекул растворителя. Способность сольватной оболочки препятствовать слипанию частиц объясняют наличием у нее сопротивления сдвигу, мешающему выдавливанию молекул среды из зазора между частицами, а также отсутствием заметного поверхностного натяжения на границе сольватного слоя и свободной фазы. Стабилизации дисперсных систем способствует введение в систему ПАВ. Неионные ПАВ, адсорбируясь на гидрофобных дисперсных частицах, превращают их в гидрофильные и увеличивают устойчивость золей.
Коллоидные растворы представляют собой термодинамически неустойчивые системы, в которых проявляется тенденция к снижению поверхностной энергии Гиббса за счет укрупнения частиц и уменьшения суммарной поверхности раздела фаз. Слипание коллоидных частиц приводит к увеличению их массы, в результате чего более крупные частицы под действием силы тяжести оседают на дно (седиментируют).
Известны, однако, многочисленные коллоидные растворы, в которых не происходит слипания частиц в течение длительного времени. Способность дисперсной системы сохранять во времени свое состояние и свойства характеризует устойчивость дисперсной системы.
Различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противостоять их слипанию между собой.
Седиментационная устойчивость коллоидных систем обусловлена малыми размерами частиц и их броуновским движением.
Агрегативная устойчивость коллоидных растворов с ионным стабилизатором обусловлена наличием на поверхности частиц диффузной ионной атмосферы, которая препятствует их слипанию. Агрегативная устойчивость - результат взаимодействия двух противоположно направленных сил, которые одновременно действуют на сближающиеся коллоидные частицы: Ван-дер-Ваальсовых сил межмолекулярного притяжения и электростатических сил отталкивания, возникающих между одноименно заряженными частицами. При значительной протяженности диффузной части мицеллы преобладают силы отталкивания, возникающие между одноименно заряженными противоионами. При малой толщине диффузного слоя частицы сближаются на расстояния, при которых молекулярное притяжение сильнее, что приводит к их агрегации (слипанию).
Таким образом, агрегативная устойчивость коллоидных систем зависит от условий формирования мицеллы - заряда твердой фазы, толщины и заряда диффузного слоя. Она тем больше, чем выше заряд твердой фазы (межфазный потенциал), чем больше толщина диффузного слоя и чем больше значение ζ -потенциала. Коллоидные растворы с ионным стабилизатором устойчивы, если ζ-потенциал превышает 50 мВ, относительно устойчивы при 30 < ζ < 50 мВ и неустойчивы при ζ < 30 мВ.
Потеря агрегативной устойчивости приводит к слипанию коллоидных частиц с образованием более крупных агрегатов; этот процесс называется коагуляцией . Следствием коагуляции является потеря седиментационной устойчивости: укрупненные частицы оседают под действием возросшей силы тяжести.
Примером коагуляции коллоидной системы служит процесс свертывания крови. Ему способствует наличие в крови катионов кальция, поэтому для длительного хранения крови, предназначенной для консервирования, эти ионы удаляют из крови различными физико-химическими методами.
Коагуляцию можно вызвать различными внешними воздействиями: добавлением небольших количеств электролита, концентрированием коллоидного раствора, изменением температуры, действием ультразвука, электромагнитного поля и др. Наибольшее практическое значение имеет коагуляция под действием электролитов.
Согласно правилу Шульце - Гарди , коагуляцию коллоидных растворов вызывают любые ионы, имеющие знак заряда, противоположный заряду гранул, причем их действие тем сильнее, чем выше заряд иона-коагулянта.
Для количественной оценки коагулирующей способности электролитов введено понятие порога коагуляции , т.е. минимальной концентрации электролита, достижение которой вызывает начало коагуляции , заметное по помутнению раствора или изменению его окраски.
1000С эл V эл
С пор = ¾¾¾¾¾
V кр + V эл
где С пор - порог коагуляции электролита, ммоль/л; С эл - исходная концентрация раствора электролита, моль/л; V эл - добавленный объем раствора электролита, вызвавший начало коагуляции; V кр - исходный объем коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующей способностью КС:
КС = 1/С пор
Коагулирующая способность иона-коагулянта пропорциональна его заряду в шестой степени. Например, коагуляцию золя AgCl, полученного в избытке Cl - -ионов и имеющего отрицательно заряженные гранулы, вызовут положительно заряженные ионы, причем при добавлении к этому золю растворов NaCl, CaCl 2 или AlCl 3 коагулирующее действие катионов Na + , Ca 2+ и Al 3+ будет находиться в приблизительном соотношении 1 6: 2 6:3 6 » 1: 64: 729. Иными словами, для коагуляции потребуется добавить гораздо меньшее количество раствора AlCl 3 , чем раствора CaCl 2 и тем более раствора NaCl. Если золь AgCl был образован в избытке потенциалопределяющих катионов Ag + и имеет свойственный им положительный заряд гранулы, то коагуляцию такого золя вызовут анионы. При этом наиболее эффективным коагулянтом в ряду KCl - K 2 SO 4 - K 3 PO 4 будет анион с наибольшим зарядом, поскольку КС(Cl -) : КС(SO 4 2-) : КС(РО 4 3-) » 1: 64: 729.
Влияние электролита на коагуляцию коллоидных растворов следует учитывать при введении электролитов в живые организмы. Например, физиологический раствор NaCl (0,9%) нельзя заменить изотоническим раствором MgSO 4 , поскольку двухзарядные ионы Mg 2+ и SO 4 2- обладают значительно большим коагулирующим действием, чем однозарядные ионы Na + и Cl - . При инъекциях электролитов в мышечную ткань следует вводить их постепенно, чтобы не вызвать локального превышения порога коагуляции, которое приведет к коагуляции биосубстратов.
О протекании процесса коагуляции можно судить по величине ζ-потенциала (рис.24). Коагуляция становится возможной при снижении толщины диффузного слоя мицеллы, которое сопровождается и уменьшением электрокинетического потенциала. Снижение величины ζ-потенциала до 25-30 мВ свидетельствует о начале коагуляции, хотя внешних признаков (помутнения или изменения окраски) может не наблюдаться из-за низкой скорости этого процесса (так называемая "скрытая" коагуляция ). Дальнейшее снижение ζ-потенциала сопровождается увеличением скорости коагуляции и помутнением раствора ("явная" коагуляция ), и при ζ = 0 скорость коагуляции максимальна. Состояние коллоидных частиц, при котором электрокинетический потенциал равен 0, называется изоэлектрическим состоянием . В этом состоянии заряд гранул равен 0, поэтому в электрическом поле они не приобретают направленного движения.
Коагуляция
скрытая явная
v медленная быстрая
 |
ζ >30 мВ ζ < 30 мВ ζ = 0
Рис.24. Зависимость скорость коагуляции от концентрации электролита-коагулянта
Коагуляцию можно также вызвать, действуя смесями электролитов . При этом существует три возможных варианта взаимодействия между электролитами-коагулянтами:
1) аддитивное действие - суммирование коагулирующего действия ионов; так, смесь солей KCl и NaNO 3 , не взаимодействующих друг с другом, проявляет аддитивное действие по отношению к коллоидам с гранулами, заряженными как положительно, так и отрицательно (в первом случае коагуляцию вызывают анионы, во втором - катионы солей);
2) антагонизм - ослабление коагулирующего действия одного электролита в присутствии другого; например, добавка Na 2 SO 4 ослабляет коагулирующее действие катионов Ва 2+ из-за того, что растворе протекает реакция Ва 2+ + SO 4 2- ® BaSO 4 , приводящая к снижению концентрации этих катионов;
3) синергизм - усиление коагулирующего действия одного электролита в присутствии другого; например, коагулирующее действие FeCl 3 и KSCN в отношении коллоидов с положительно заряженными гранулами (коагулянты - однозарядные анионы) резко возрастает при их совместном присутствии, поскольку в результате реакции Fe 3+ + 6SCN - ® 3- образуется трехзарядный комплексный анион, проявляющий очень высокую коагулирующую способность.
При смешении двух коллоидных растворов, содержащих частицы с противоположными зарядами гранул происходит взаимная коагуляция - слипание разноименно заряженных гранул в крупные агрегаты. При этом коагуляция происходит тем полнее, чем полнее нейтрализуются заряды гранул.
Свежеполученный при коагуляции осадок можно вернуть в коллоидное состояние. Процесс, обратный коагуляции - превращение осадка в устойчивый коллоидный раствор, называется пептизацией . Пептизации способствует промывание осадка чистым растворителем, вымывающим из системы ионы-коагулянты, и добавление электролита-пептизатора, содержащего ионы, способные, адсорбируясь на поверхности частиц осадка, восстановить ионные атмосферы вокруг них и перевести их в коллоидное состояние. Пептизация усиливается при перемешивании и нагревании.
Процесс пептизации лежит в основе лечения многих заболеваний: рассасывания атеросклеротических бляшек на стенках кровеносных сосудов, почечных и печеночных камней. Однако застарелые тромбы и уплотнившиеся камни практически не пептизируются.
Устойчивость коллоидных растворов можно повысить добавлением к ним некоторых высокомолекулярных соединений (ВМС). Это явление получило название коллоидной защиты. Защитное действие ВМС объясняется тем, что они адсорбируются на поверхности коллоидных частиц. При этом гидрофобные участки их структур (углеводородные радикалы) обращены к частицам дисперсной фазы, а гидрофильные фрагменты (полярные группы) обращены наружу, к воде. Вокруг мицеллы образуется дополнительная оболочка из макромолекул ВМС и их собственных гидратных оболочек, которая препятствует сближению коллоидных частиц.
По отношению к водным коллоидным растворам защитным действием обладают растворимые в воде белки, полисахариды, пектины. Белки препятствуют выпадению в осадок малорастворимых холестерина и солей кальция на стенках кровеносных сосудов, образованию камней в мочевыводящих и желчепроводящих путях. В фармации защитные свойства ВМС используются для повышения устойчивости лекарственных препаратов, находящихся в коллоидном состоянии.
Для обеспечения коллоидной защиты необходимо создать достаточно высокую концентрацию ВМС, обеспечивающую образование мономолекулярной защитной оболочки вокруг мицеллы. Введение небольшого количества ВМС может привести к обратному эффекту: макромолекулы взаимодействуют одновременно с несколькими коллоидными частицами, связывая их с образованием рыхлых хлопьев. Агрегирование частиц дисперсной фазы в лиофобных коллоидных растворах под действием небольших количеств ВМС называется флокуляцией .
На явлении флокуляции основан метод очистки природных и питьевых вод. В качестве флокулянта используется хорошо растворимый в воде синтетический полимер - полиакриламид.
ения, в то время как по-и молекулярных систем определяется
3. ГЕТЕРОГЕННОСТЬ КОЛЛОИДНЫХ СИСТЕМ КАК ОСНОВНОЕ ОТЛИЧИЕ ИХ ОТ МОЛЕКУЛЯРНЫХ РАСТВОРОВ
Мы уже говорили о том, что агрегативная неустойчивость -> специфическая особенность коллоидных систем. Это свойство коллоидных систем имеет большое практическое значение. Не будет преувеличением сказать, что основной задачей технолога производственного процесса, в котором имеют место коллоидные системы, является либо поддержание агрегативной устойчивости системы, либо, наоборот, обеспечение известных условий коагуляции.
Агрегативная неустойчивость является центральной проблемой коллоидной химии, и уже в начале курса следует хотя бы в самом общем виде рассмотреть, какие причины обусловливают агрега-тивную неустойчивость коллоидных систем и почему многие коллоидные системы, несмотря на их принципиальную агрегативную неустойчивость, существуют весьма продолжительное время. Причины неустойчивости коллоидных систем могут быть объяснены с двух точек зрения - термодинамической и кинетической.
Согласно термодинамике, агрегативная неустойчивость коллоидных систем обусловлена достаточно большой и всегда положительной свободной поверхностной энергией, сосредоточенной на межфазной поверхности системы. Поскольку поверхностная энергия представляет свободную энергию и так как все системы, обладающие избыточной свободной энергией, неустойчивы, это обусловливает способность коллоидных систем коагулировать. При коагуляции частицы слипаются, при этом межфазная поверхность хотя бы частично исчезает и, таким образом, уменьшается свободная энергия системы. Впрочем, Смолуховский, а в последнее время Г. А. Мартынов обратили внимание на то, что для уменьшения свободной энергии системы непосредственный контакт частиц не обязателен. Свободная энергия может уменьшаться и тогда, когда частицы не входят в непосредственное соприкосновение, а сближаются лишь на некоторое расстояние, позволяющее им взаимодействовать через слой, разделяющий их среды.
В самом деле, пусть
где F - свободная поверхностная энергия всей системы; st, % - межфазная поверхность; f - удельная свободная поверхностная энергия.
Величина f представляет собой сумму межфазной поверхностной энергии fa, определяемой состоянием монослоя на границе фаз, и свободной энергии fv вблизи поверхности, т. е. f = fa+ fv. Объемно-поверхностный вклад fv обусловлен изменением состояния слоев жидкости вблизи поверхности раздела фаз. Несмотря на то что вообще fa^fv, устойчивость системы "в большинстве случаев связана именно с изменением fv, так как при образовании агрегатов из твердых частиц граница раздела фаз обычно не исчезает. Поэтому в ходе коагуляции величина /а остается практически постоянной, а изменяется fv, причем степень изменения зависит от уменьшения расстояния между частицами. Конечно, все это не относится к эмульсиям, где имеет место коалесцеиция, то есть слияние частиц с полной ликвидацией первоначально разделяющей частицы межфазной поверхности.
Поскольку коллоидные системы, обладающие большой удельной поверхностью и большой свободной энергией, являются принципиально неравновесными системами, к ним неприложимо известное правило фаз. Такие системы, очевидно, всегда будут стремиться к равновесному состоянию, отвечающему разделению системы на две сплошные фазы с минимальной межфазной поверхностью, хотя это равновесие практически может никогда и не наступить. Термодинамическое толкование причин устойчивости или неустойчивости коллоидных систем чрезвычайно просто. Однако, как и всякая термодинамическая трактовка, это объяснение формально, т. е. она не раскрывает сущности свойства агрега-тивной неустойчивости. Кроме того, термодинамика не устанавливает связи между свободной энергией системы и тем, как долго система может пребывать в неравновесном состоянии. Поэтому более полным в данном случае является объяснение агрегативной неустойчивости или устойчивости коллоидных систем с позиций физической кинетики.
Согласно кинетическим представлениям неустойчивость или устойчивость коллоидной или микрогетерогенной системы определяется соотношением сил, действующих между отдельными ее часгицами. К таким силам относятся силы двух родов: силы сцепления, или аттракционные силы, стремящиеся сблизить частицы и образовать из них агрегат, и силы отталкивания, препятствующие коагуляции.
Силы сцепления имеют обычно ту же природу, что и межмолекулярные (ван-дер-ваальсовы) силы. Существенно, что силы, действующие между частицами, очень быстро возрастают при сближении частиц.
Силами отталкивания могут являться электрические силы, возникающие в результате избирательной адсорбции межфазной поверхностью одного из ионов электролита, присутствующего в системе. Поскольку частицы дисперсной фазы по своей природе одинаковы и адсорбируют всегда определенный ион, все они приобретают электрический заряд одного и того же знака и испытывают взаимное отталкивание, что препятствует сближению их на такие расстояния, где уже могут действовать весьма значительные аттракционные силы. Другой причиной, препятствующей сближению коллоидных частиц до расстояний, на которых начинают превалировать силы сцепления, может явиться образование на поверхности частиц сольватной оболочки из молекул среды. Такая оболочка возникает в результате адсорбции дисперсной фазой либо молекул среды, либо молекул или ионов третьего компонента (стабилизатора) системы. Помимо этих двух факторов существуют и другие факторы, обеспечивающие агрегатнвную устойчивость коллоидным системам. Подробно все факторы устойчивости рассмотрены в гл. IX.
Таким образом, относительная устойчивость коллоидной системы определяется тем, достаточно ли велики силы отталкивания, чтобы воспрепятствовать сближению частиц на близкие расстояния. Понятно, что такое объяснение не противоречит принципиальной неустойчивости огромного большинства коллоидных систем, поскольку при непосредственной близости поверхностей частиц силы сцепления, как правило, больше сил отталкивания и двум отдельным частицам энергетически обычно выгодней образовать агрегат. В дальнейшем мы увидим, что имеется много способов уменьшения сил отталкивания, и в частности, одним из таких способов является введение в систему электролитов.
4. РАСКЛИНИВАЮЩЕЕ ДАВЛЕНИЕ*
* Этот раздел главы написан Б. В. Дерягииым.
При утоньшении прослойки жидкости, разделяющей поверхности двух твердых тел или вообще двух любых адсорбировавших ионы фаз, между поверхностями этих фаз возникают* силы взаимодействия двоякого рода. Во-первых, силы, зависящие от притяжения между молекулами обоих тел, между молекулами жидкости и между молекулами жидкости и каждого тела (или фазы).
Если оба тела одинаковы, то эти силы приводят к притяжению тел, стремящемуся утоньшить прослойку жидкости. Во-вторых, в результате действия сил электрической природы между одинаковыми телами всегда возникает отталкивание, вызывающее утолщение жидкой прослойки. Поэтому, чтобы толщина прослойки не изменялась и система в целом сохраняла т